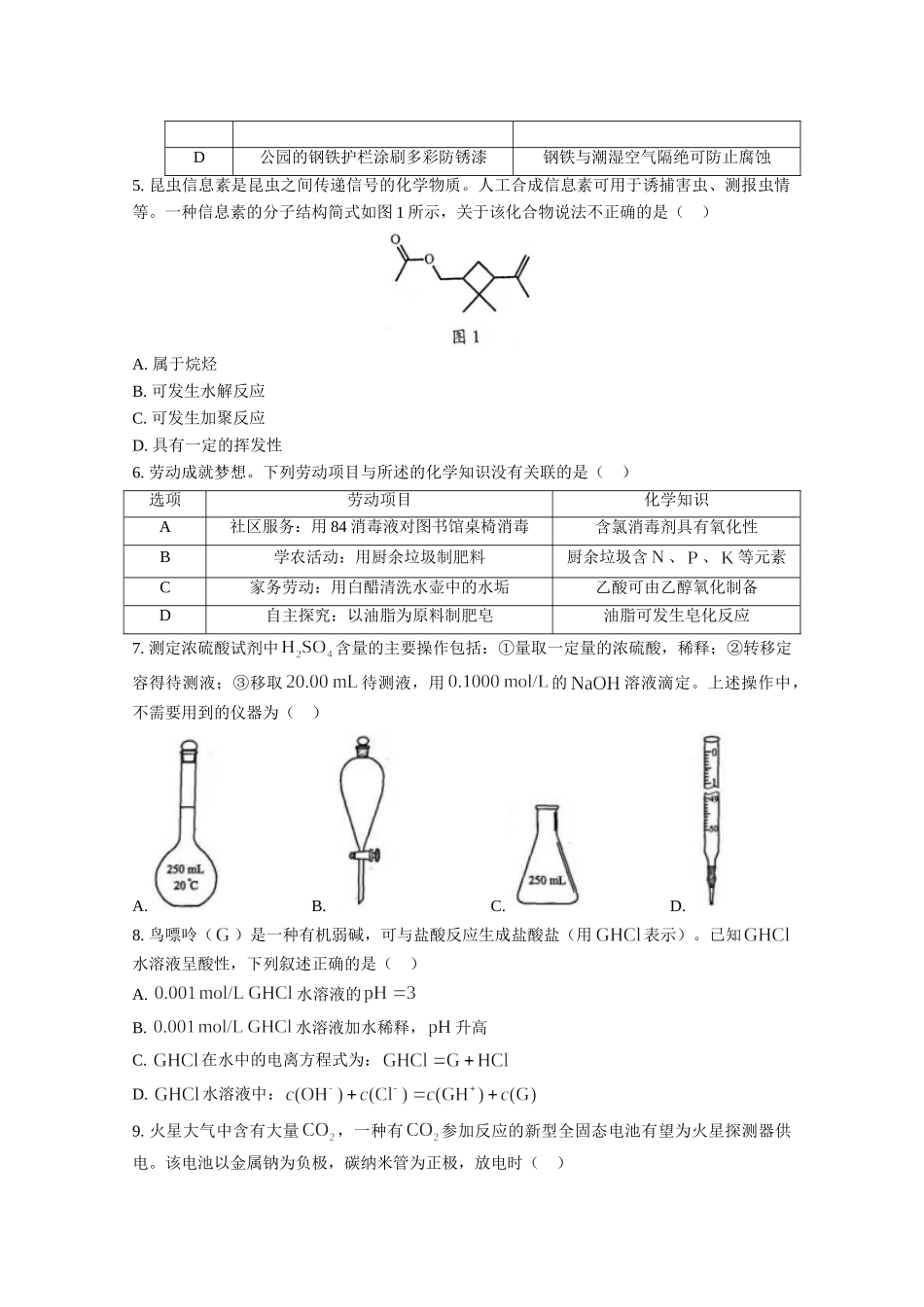
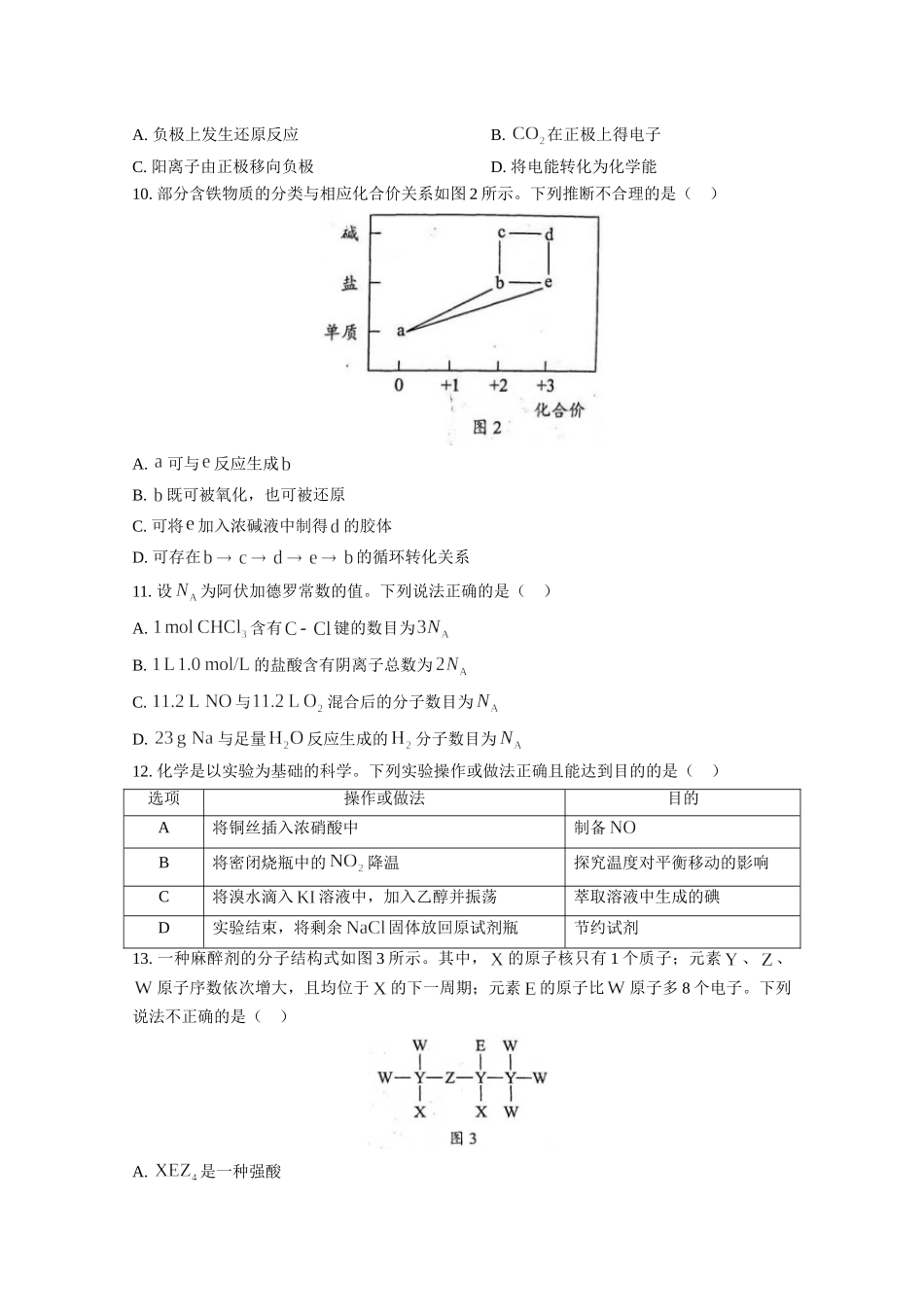
2021年广东省普通高中学业水平选择性考试化学一、选择题:本题共16小题,共44分。第1~10小题,每小题2分;第11~16小题,每小题4分。在每小题给出的四个选项中,只有一项是符合题目要求的。1.今年五一假期,人文考古游持续成为热点。很多珍贵文物都记载着中华文明的灿烂成就,具有深邃的文化寓意和极高的学术价值。下列国宝级文物主要由合金材料制成的是()选项ABCD文物名称铸客大铜鼎河姆渡出土陶灶兽首玛瑙杯角形玉杯2.广东有众多国家级非物质文化遗产,如广东剪纸、粤绣、潮汕工夫茶艺和香云纱染整技艺等。下列说法不正确的是()A.广东剪纸的裁剪过程不涉及化学变化B.冲泡工夫茶时茶香四溢,体现了分子是运动的C.制作粤绣所用的植物纤维布含有天然高分子化合物D.染整技艺中去除丝胶所用的纯碱水溶液属于纯净物3.“天问一号”着陆火星,“嫦娥五号”采回月壤。腾飞中国离不开化学,长征系列运载火箭使用的燃料有液氢和煤油等化学品。下列有关说法正确的是()A.煤油是可再生能源B.燃烧过程中热能转化为化学能C.火星陨石中的质量数为20D.月壤中的与地球上的互为同位素4.化学创造美好生活。下列生产活动中,没有运用相应化学原理的是()选项生产活动化学原理A用聚乙烯塑料制作食品保鲜膜聚乙烯燃烧生成和B利用海水制取溴和镁单质可被氧化、可被还原C利用氢氟酸刻蚀石英制作艺术品氢氟酸可与反应D公园的钢铁护栏涂刷多彩防锈漆钢铁与潮湿空气隔绝可防止腐蚀5.昆虫信息素是昆虫之间传递信号的化学物质。人工合成信息素可用于诱捕害虫、测报虫情等。一种信息素的分子结构简式如图1所示,关于该化合物说法不正确的是()A.属于烷烃B.可发生水解反应C.可发生加聚反应D.具有一定的挥发性6.劳动成就梦想。下列劳动项目与所述的化学知识没有关联的是()选项劳动项目化学知识A社区服务:用84消毒液对图书馆桌椅消毒含氯消毒剂具有氧化性B学农活动:用厨余垃圾制肥料厨余垃圾含、、等元素C家务劳动:用白醋清洗水壶中的水垢乙酸可由乙醇氧化制备D自主探究:以油脂为原料制肥皂油脂可发生皂化反应7.测定浓硫酸试剂中含量的主要操作包括:①量取一定量的浓硫酸,稀释;②转移定容得待测液;③移取待测液,用的溶液滴定。上述操作中,不需要用到的仪器为()A.B.C.D.8.鸟嘌呤()是一种有机弱碱,可与盐酸反应生成盐酸盐(用表示)。已知水溶液呈酸性,下列叙述正确的是()A.水溶液的B.水溶液加水稀释,升高C.在水中的电离方程式为:D.水溶液中:9.火星大气...