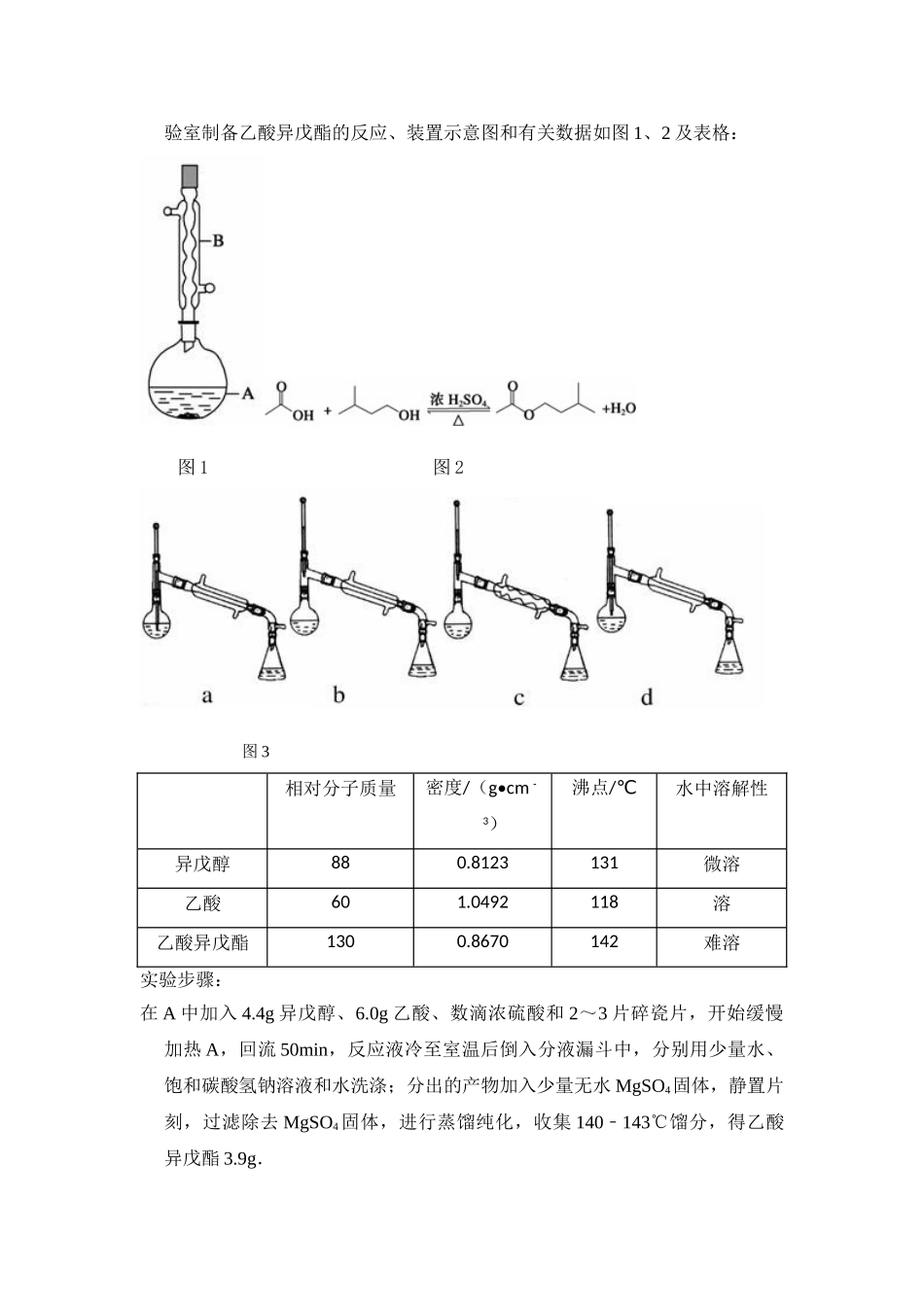
2014年全国统一高考化学试卷(新课标Ⅰ)一、选择题(本题共7小题,每小题6分,共42分)1.(6分)下列化合物中同分异构体数目最少的是()A.戊烷B.戊醇C.戊烯D.乙酸乙酯2.(6分)化学与社会、生活密切相关,对下列现象或事实的解释正确的是()选项现象或事实解释A用热的烧碱溶液洗去油污Na2CO3可直接和油污反应B漂白粉在空气中久置变质漂白粉中的CaCl2与空气中的CO2反应生成CaCO3C施肥时,草木灰(有效成分为K2CO3)不能与NH4Cl混合使用K2CO3与NH4Cl反应生成氨气会降低肥效DFeCl3溶液可用于铜质印刷线路板制作FeCl3能从含有Cu2+的溶液中置换出铜A.AB.BC.CD.D3.(6分)已知分解1molH2O2放出热量98kJ,在含少量I﹣的溶液中,H2O2分解的机理为:H2O2+I﹣→H2O+IO﹣慢H2O2+IO﹣→H2O+O2+I﹣快下列有关该反应的说法正确的是()A.反应速率与I﹣的浓度有关B.IO﹣也是该反应的催化剂C.反应活化能等于98kJ•mol1﹣D.v(H2O2)=v(H2O)=v(O2)4.(6分)X,Y,Z均为短周期元素,X,Y处于同一周期,X,Z的最低价离子分别为X2﹣和Z﹣,Y+和Z﹣具有相同的电子层结构。下列说法正确的是()A.原子最外层电子数:X>Y>ZB.单质沸点:X>Y>ZC.离子半径:X2﹣>Y+>Z﹣D.原子序数:X>Y>Z5.(6分)溴酸银(AgBrO3)溶解度随温度变化曲线如图所示,下列说法错误的是()A.溴酸银的溶解是放热过程B.温度升高时溴酸银溶解速度加快C.60℃时溴酸银的Ksp约等于6×104﹣D.若硝酸钾中含有少量溴酸银,可用重结晶方法提纯6.(6分)下列有关仪器使用方法或实验操作正确的是()A.洗净的锥形瓶和容量瓶可以放进烘箱烘干B.酸式滴定管装标准溶液前,必须先用该溶液润洗C.酸碱滴定实验中,用待滴定溶液润洗锥形瓶以减小实验误差D.用容量瓶配溶液时,若加水超过刻度线,立即用滴管吸出多余液体7.(6分)利用如图所示装置进行下列实验,能得出相应实验结论是()选项①②③实验结论A稀硫酸Na2SAgNO3与AgCl的浊液Ksp(AgCl)>Ksp(Ag2S)B浓硫酸蔗糖溴水浓硫酸具有脱水性、氧化性C稀盐酸Na2SO3Ba(NO3)2溶液SO2与可溶性钡盐均可生成白色沉淀D浓硝酸Na2CO3Na2SiO3溶液酸性:硝酸>碳酸>硅酸A.AB.BC.CD.D三、非选择题:包括必考题和选考题两部分(一)必考题(共58分)8.(13分)乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味,实验室制备乙酸异戊酯的反应、装置示意图和有关数据如图1、2及表格:图1图2图3相对分子质量密度/(g•...