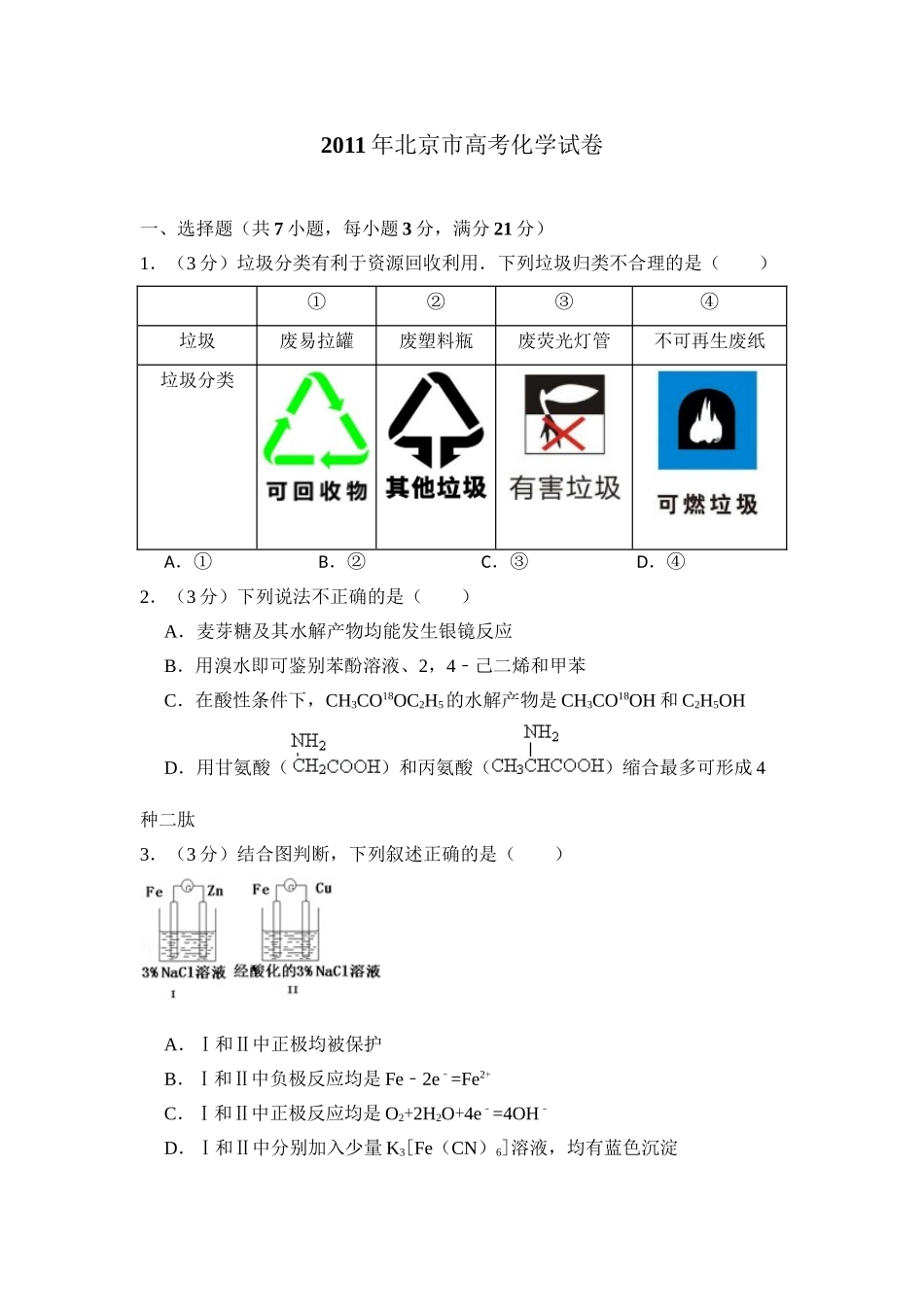
2011年北京市高考化学试卷一、选择题(共7小题,每小题3分,满分21分)1.(3分)垃圾分类有利于资源回收利用.下列垃圾归类不合理的是()①②③④垃圾废易拉罐废塑料瓶废荧光灯管不可再生废纸垃圾分类A.①B.②C.③D.④2.(3分)下列说法不正确的是()A.麦芽糖及其水解产物均能发生银镜反应B.用溴水即可鉴别苯酚溶液、2,4﹣己二烯和甲苯C.在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OHD.用甘氨酸()和丙氨酸()缩合最多可形成4种二肽3.(3分)结合图判断,下列叙述正确的是()A.Ⅰ和Ⅱ中正极均被保护B.Ⅰ和Ⅱ中负极反应均是Fe2e﹣﹣=Fe2+C.Ⅰ和Ⅱ中正极反应均是O2+2H2O+4e﹣=4OH﹣D.Ⅰ和Ⅱ中分别加入少量K3[Fe(CN)6]溶液,均有蓝色沉淀4.(3分)下列与处理方法对应的反应方程式不正确的是()A.用Na2S去除废水中的Hg2+:Hg2++S2﹣=HgS↓B.用催化法处理汽车尾气中的CO和NO:CO+NOC+NO2C.向污水中投放明矾,生成能凝聚悬浮物的胶体:Al3++3H2OAl(OH)3(胶体)+3H+D.用高温催化氧化法去除烃类废气(CxHy):CxHy+(x+)O2xCO2+H2O5.(3分)25℃、101kPa下:①2Na(s)+O2(g)=Na2O(s)△H=﹣414kJ.mol1﹣②2Na(s)+O2(g)=Na2O2(s)△H=511kJ﹣.mol1﹣下列说法不正确的是()A.①和②产物的阴阳离子个数比相等B.①和②生成等物质的量的产物,转移电子数相同C.常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快D.25℃、101kPa下:Na2O2(s)+2Na(s)=2Na2O(s)△H=317kJ﹣.mol1﹣6.(3分)下列实验方案中,不能测定Na2CO3和NaHCO3混合物中Na2CO3质量分数()A.取a克混合物充分加热,减重b克B.取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体C.取a克混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b克D.取a克混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体7.(3分)已知反应:2CH3COCH3(l)⇌CH3COCH2COH(CH3)2(l).取等量CH3COCH3,分别在0℃和20℃下,测得其转化分数随时间变化的关系曲线(Yt﹣)如图所示.下列说法正确的是()A.b代表0℃下CH3COCH3的Yt﹣曲线B.反应进行到20min末,CH3COCH3的C.升高温度可缩短反应达平衡的时间并能提高平衡转化率D.从Y=0到Y=0.113,CH3COCH2COH(CH3)2的二、解答题(共4小题,满分58分)8.(12分)在温度t1和t2下,X2(g)和H2反应生成HX的平衡常数如下表:化学方程式K(t1)K...