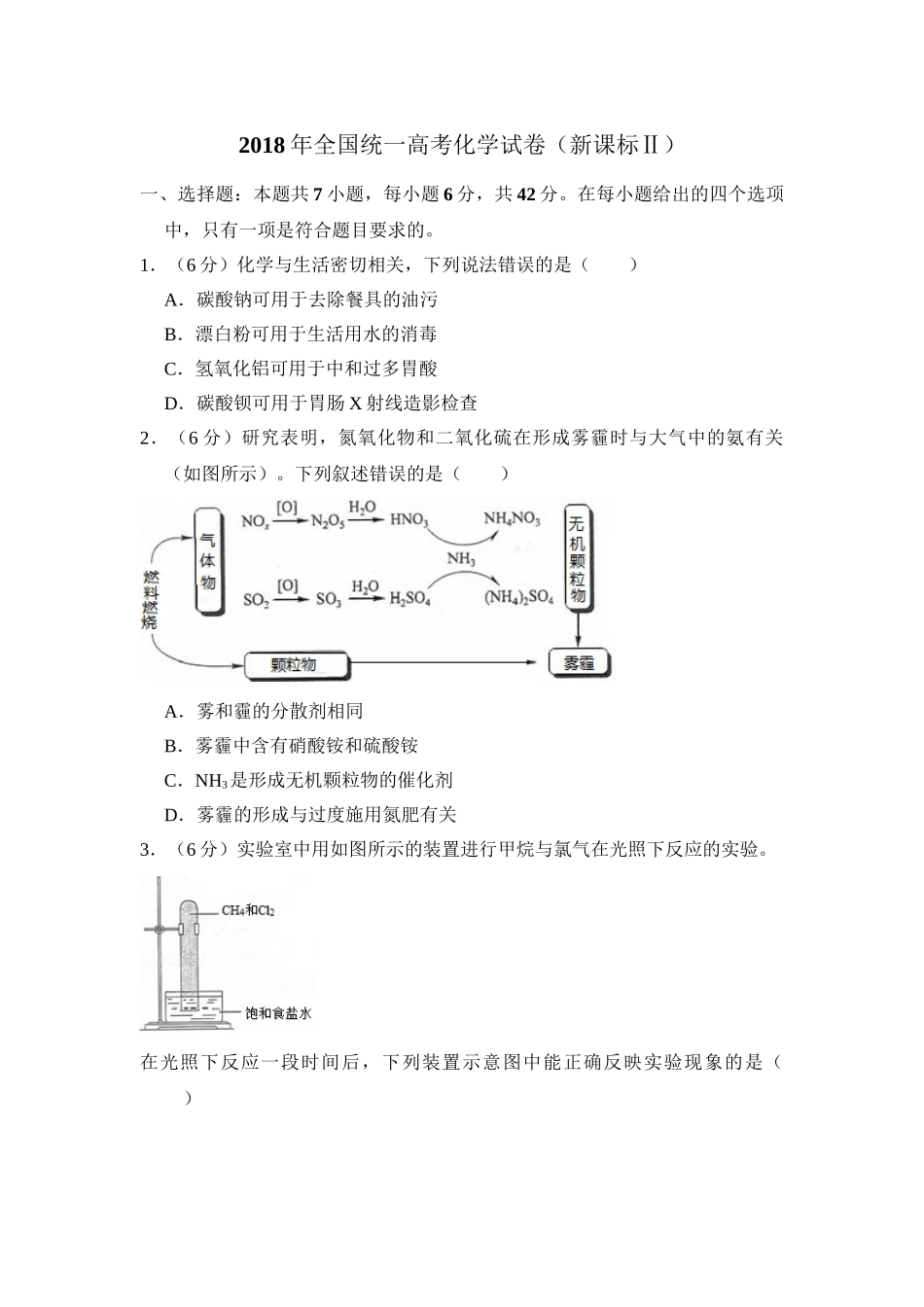
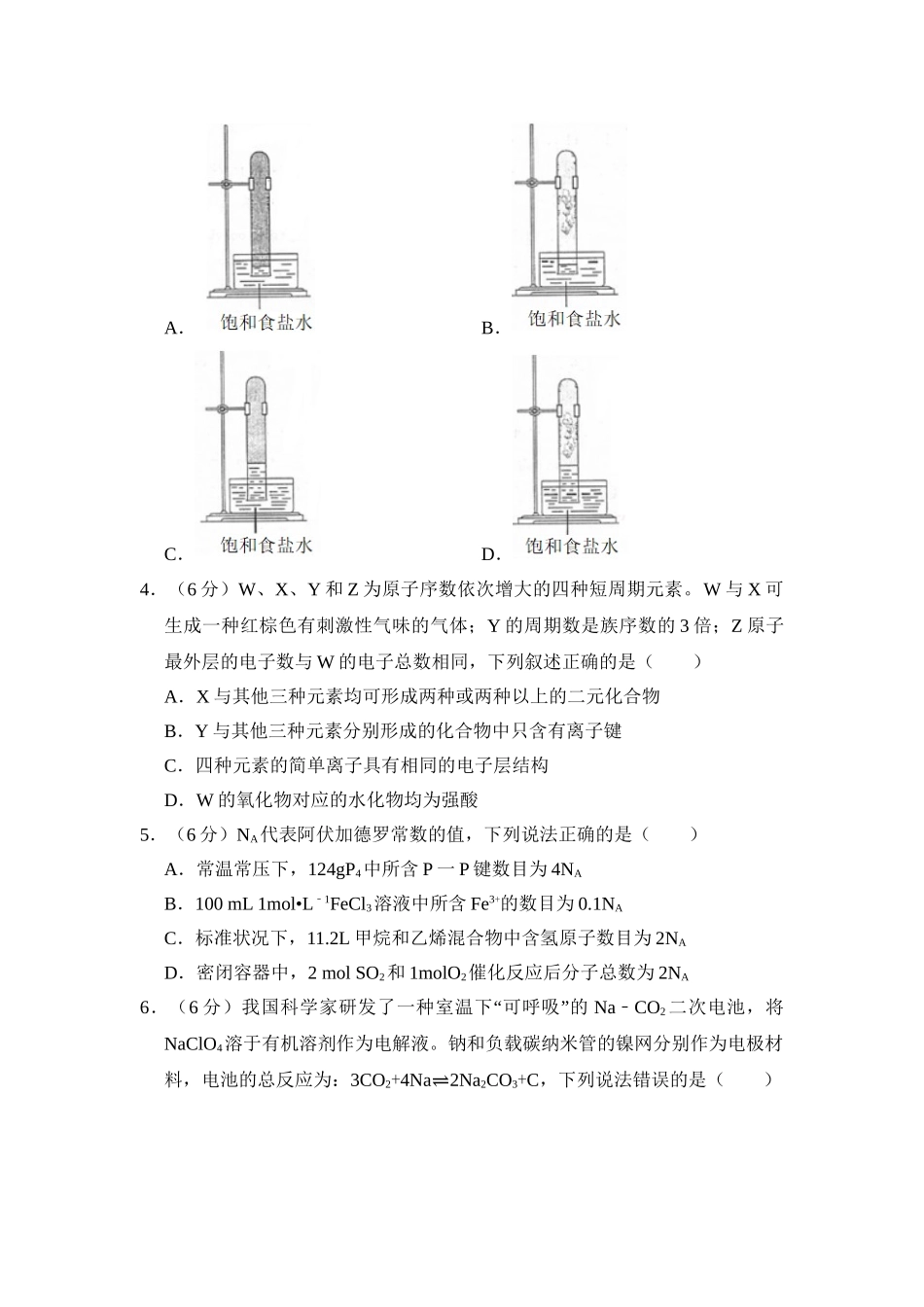
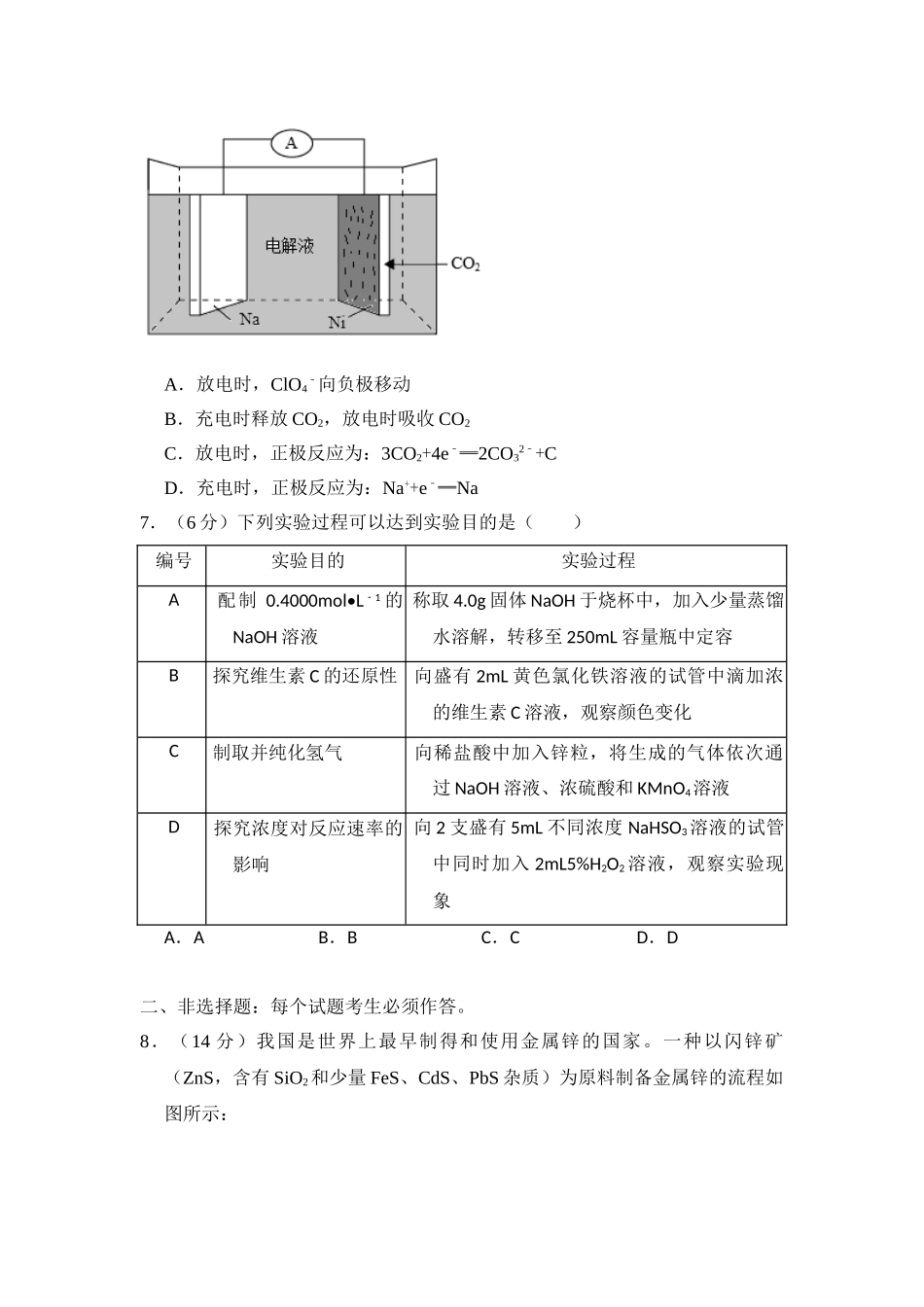
2018年全国统一高考化学试卷(新课标Ⅱ)一、选择题:本题共7小题,每小题6分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。1.(6分)化学与生活密切相关,下列说法错误的是()A.碳酸钠可用于去除餐具的油污B.漂白粉可用于生活用水的消毒C.氢氧化铝可用于中和过多胃酸D.碳酸钡可用于胃肠X射线造影检查2.(6分)研究表明,氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如图所示)。下列叙述错误的是()A.雾和霾的分散剂相同B.雾霾中含有硝酸铵和硫酸铵C.NH3是形成无机颗粒物的催化剂D.雾霾的形成与过度施用氮肥有关3.(6分)实验室中用如图所示的装置进行甲烷与氯气在光照下反应的实验。在光照下反应一段时间后,下列装置示意图中能正确反映实验现象的是()A.B.C.D.4.(6分)W、X、Y和Z为原子序数依次增大的四种短周期元素。W与X可生成一种红棕色有刺激性气味的气体;Y的周期数是族序数的3倍;Z原子最外层的电子数与W的电子总数相同,下列叙述正确的是()A.X与其他三种元素均可形成两种或两种以上的二元化合物B.Y与其他三种元素分别形成的化合物中只含有离子键C.四种元素的简单离子具有相同的电子层结构D.W的氧化物对应的水化物均为强酸5.(6分)NA代表阿伏加德罗常数的值,下列说法正确的是()A.常温常压下,124gP4中所含P一P键数目为4NAB.100mL1mol•L1﹣FeCl3溶液中所含Fe3+的数目为0.1NAC.标准状况下,11.2L甲烷和乙烯混合物中含氢原子数目为2NAD.密闭容器中,2molSO2和1molO2催化反应后分子总数为2NA6.(6“”分)我国科学家研发了一种室温下可呼吸的NaCO﹣2二次电池,将NaClO4溶于有机溶剂作为电解液。钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:3CO2+4Na⇌2Na2CO3+C,下列说法错误的是()A.放电时,ClO4﹣向负极移动B.充电时释放CO2,放电时吸收CO2C.放电时,正极反应为:3CO2+4e﹣═2CO32﹣+CD.充电时,正极反应为:Na++e﹣═Na7.(6分)下列实验过程可以达到实验目的是()编号实验目的实验过程A配制0.4000mol•L1﹣的NaOH溶液称取4.0g固体NaOH于烧杯中,加入少量蒸馏水溶解,转移至250mL容量瓶中定容B探究维生素C的还原性向盛有2mL黄色氯化铁溶液的试管中滴加浓的维生素C溶液,观察颜色变化C制取并纯化氢气向稀盐酸中加入锌粒,将生成的气体依次通过NaOH溶液、浓硫酸和KMnO4溶液D探究浓度对反应速率的影响向2支盛有5mL不同浓度NaHSO3溶液的试管中同时加入2mL...