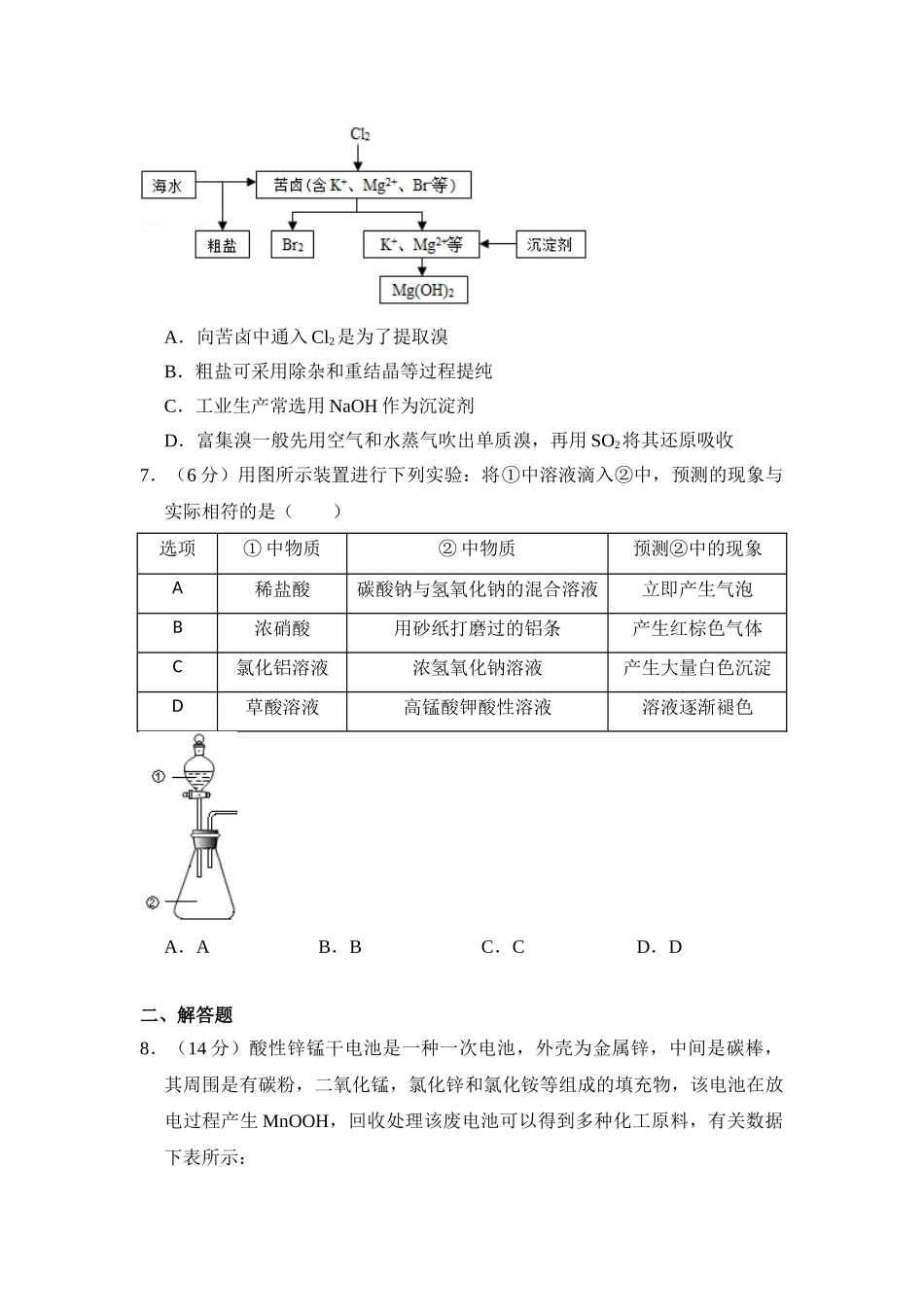
2015年全国统一高考化学试卷(新课标Ⅱ)一、选择题(共7小题,每小题6分,满分42分)1.(6分)食品干燥剂应无毒、无味、无腐蚀性及环境友好.下列说法错误的是()A.硅胶可用作食品干燥剂B.P2O5不可用作食品干燥剂C.六水合氯化钙可用作食品干燥剂D.加工后具有吸水性的植物纤维可用作食品干燥剂2.(6分)某羧酸酯的分子式为C18H26O5,1mol该酯完全水解可得到1mol羧酸和2mol乙醇,该羧酸的分子式为()A.C14H18O5B.C14H16O4C.C16H22O5D.C16H20O53.(6分)原子序数依次增大的元素a、b、c、d,它们的最外层电子数分别为1、6、7、1.a﹣的电子层结构与氦相同,b和c的次外层有8个电子,c﹣和d+的电子层结构相同.下列叙述错误的是()A.a和其他3种元素均能形成共价化合物B.元素的非金属性次序为c>b>aC.d和其他3种元素均能形成离子化合物D.元素a、b、c各自最高和最低化合价的代数和分别为0、4、64.(6分)NA代表阿伏加德罗常数的值.下列叙述正确的是()A.60g丙醇中存在的共价键总数为10NAB.1L0.1mol•L1﹣的NaHCO3溶液中HCO3﹣和CO32﹣离子数之和为0.1NAC.钠在空气中燃烧可生成多种氧化物.23g钠充分燃烧时转移电子数为1NAD.235g核素92235U发生裂变反应:92235U+01n3890Sr+54136Xe+1001n净产生的中子(01n)数为10NA5.(6分)分子式为C5H10O2且可与碳酸氢钠溶液反应放出气体的有机化合物有()A.3种B.4种C.5种D.6种6.(6分)海水开发利用的部分过程如图所示.下列说法错误的是()A.向苦卤中通入Cl2是为了提取溴B.粗盐可采用除杂和重结晶等过程提纯C.工业生产常选用NaOH作为沉淀剂D.富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收7.(6分)用图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是()选项①中物质②中物质预测②中的现象A稀盐酸碳酸钠与氢氧化钠的混合溶液立即产生气泡B浓硝酸用砂纸打磨过的铝条产生红棕色气体C氯化铝溶液浓氢氧化钠溶液产生大量白色沉淀D草酸溶液高锰酸钾酸性溶液溶液逐渐褪色A.AB.BC.CD.D二、解答题8.(14分)酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是有碳粉,二氧化锰,氯化锌和氯化铵等组成的填充物,该电池在放电过程产生MnOOH,回收处理该废电池可以得到多种化工原料,有关数据下表所示:溶解度/(g/100g水)温度/℃化合物020406080100NH4Cl29.337.245.855.365.677.3ZnCl2343395452488541614化合物Zn(OH)2Fe(...