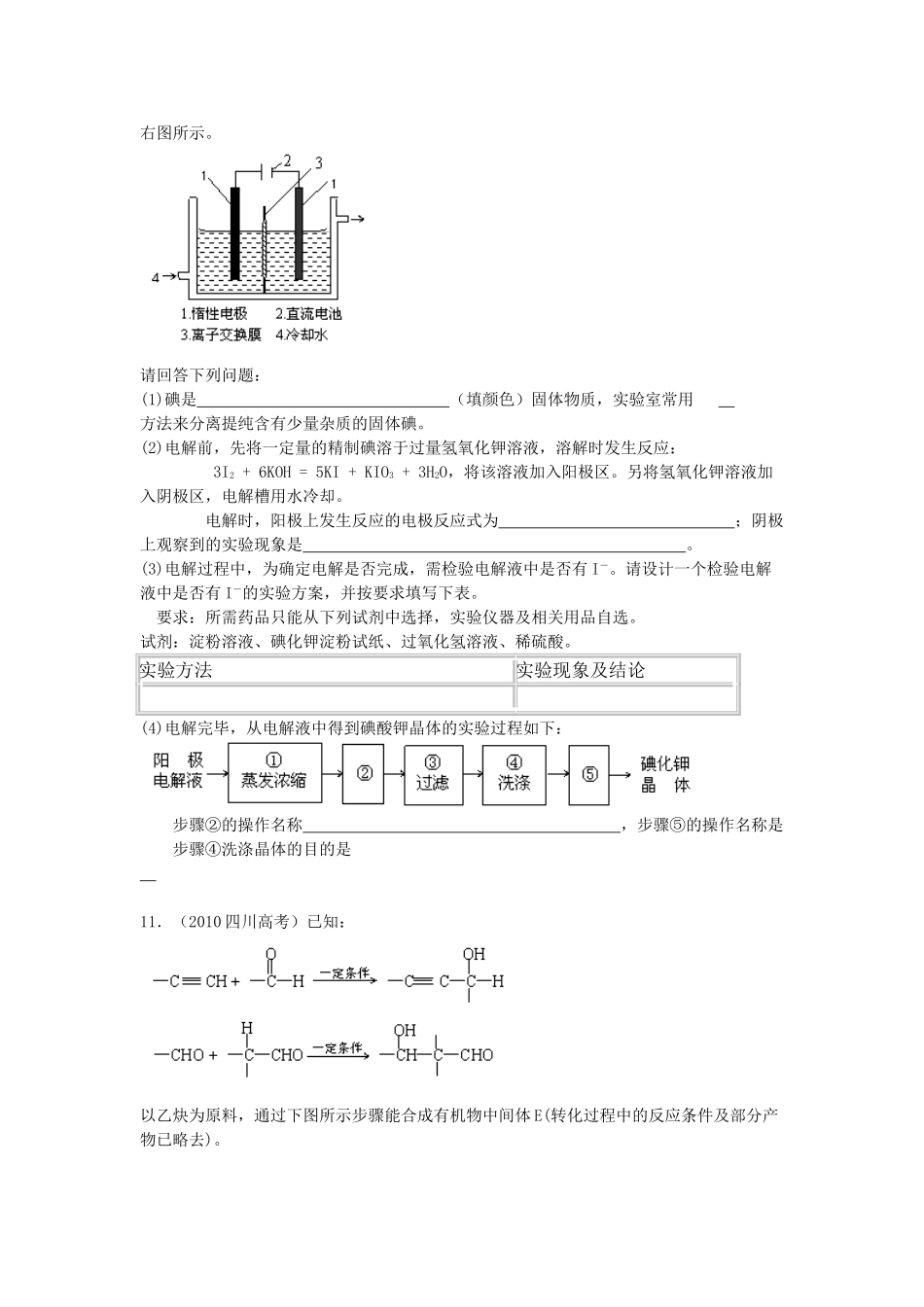
2010年四川省高考理综试题可能用到的相对原子质量:H1C12N14O16Na23Mg24Al27S32Cl35.5Ca40Mn55Fe56Co59Cu64Br80Ba1371.(2010四川高考)节能减排对发展经济、保护环境有重要意义。下列措施不能减少二氧化碳排放的是A.利用太阳能制氢B.关停小火电企业C.举行“地球一小时”熄灯活动D.推广使用煤液化技术2.(2010四川高考)NA表示阿伏伽德罗常数的值,下列说法正确的是A.标准状况下,22.4L二氯甲烷的分子数约为NA个B.盛有SO2的密闭容器中含有NA个氧原子,则SO2的物质的量为0.5molC.17.6g丙烷中所含的极性共价键为4NA个D.电解精炼铜时,若阴极得到电子数为2NA个,则阳极质量减少64g3.(2010四川高考)下列说法正确的是A.原子最外层电子数为2的元素一定处于周期表第ⅡA族B.主族元素X、Y能形成XY2型化合物,则X与Y的原子序数之差可能为2或5C.氯化氢的沸点比氟化氢的沸点高D.同主族元素形成的氧化物的晶体类型均相同4.(2010四川高考)下列离子方程式书写正确的是A.向明矾溶液中加入过量的氢氧化钡溶液:Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2OB.向氢氧化亚铁中加入足量的稀硝酸:Fe(OH)2+2H+=Fe2++2H2OC.向磷酸二氢铵溶液中加入足量的氢氧化钠溶液:NH4++OH-=NH3∙H2OD.向CH2BrCOOH中加入足量的氢氧化钠溶液并加热:CH2BrCOOH+OH-CH2BrCOO-+H2O5.(2010四川高考)有关①100mL0.1mol/LNaHCO3、②100mL0.1mol/LNa2CO3两种溶液的叙述不正确的是A.溶液中水电离出的H+个数:②>①B.溶液中阴离子的物质的量浓度之和:②>①C.①溶液中:c(CO32-)>c(H2CO3)D.②溶液中:c(HCO3-)>c(H2CO3)6.(2010四川高考)中药狼把草的成分之一M具有消炎杀菌作用,M的结构如图所示:下列叙述正确的是A.M的相对分子质量是180B.1molM最多能与2molBr2发生反应C.M与足量的NaOH溶液发生反应时,所得有机产物的化学式为C9H4O5Na4D.1molM与足量NaHCO3反应能生成2molCO27.(2010四川高考)标准状况下VL氨气溶解在1L水中(水的密度近似为1g/mL),所得溶液的密度为ρg/mL,质量分数为ω,物质的量浓度为cmol/L,则下列关系中不正确的是A.ρ=(17V+22400)/(22.4+22.4V)B.ω=17c/(1000ρ)C.ω=17V/(17V+22400)D.c=1000Vρ/(17V+22400)8.(2010四川高考)反应aM(g)+bN(g)cP(g)+dQ(g)达到平衡时。M的体积分数y(M)与反应条件的关系如图所示。其中z表示反应开始时N的物质的量与M的物质的量之比。下列说法正确的是A.同温同压同Z时,加入催化剂,平衡时Q的体积分数增加B.同压...