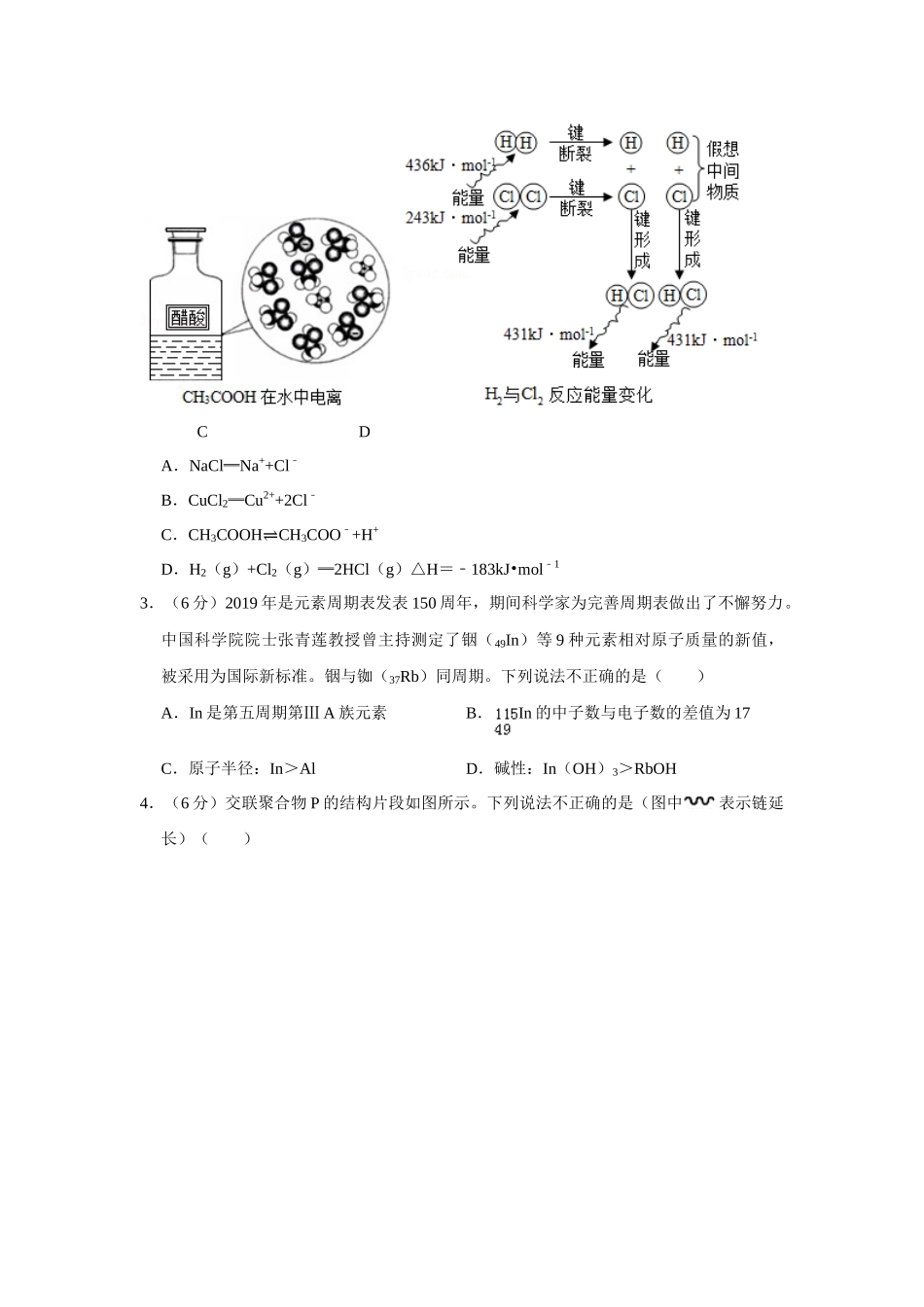
2019年北京市高考化学试卷一、选择题:本部分共7小题,每小题6分,共42分。在每小题列出的四个选项中,选出最符合题目要求的一项。1.(6分)下列我国科研成果所涉及材料中,主要成分为同主族元素形成的无机非金属材料的是()A.4.03米大口径碳化硅反射镜B.2022年冬奥会聚氨酯速滑服C.能屏蔽电磁波的碳包覆银纳米线D.“玉兔二号”钛合金筛网轮2.(6分)下列示意图与化学用语表述内容不相符的是(水合离子用相应离子符号表示)()ABCDA.NaCl═Na++Cl﹣B.CuCl2═Cu2++2Cl﹣C.CH3COOH⇌CH3COO﹣+H+D.H2(g)+Cl2(g)═2HCl(g)△H=﹣183kJ•mol﹣13.(6分)2019年是元素周期表发表150周年,期间科学家为完善周期表做出了不懈努力。中国科学院院士张青莲教授曾主持测定了铟(49In)等9种元素相对原子质量的新值,被采用为国际新标准。铟与铷(37Rb)同周期。下列说法不正确的是()A.In是第五周期第ⅢA族元素B.In的中子数与电子数的差值为17C.原子半径:In>AlD.碱性:In(OH)3>RbOH4.(6分)交联聚合物P的结构片段如图所示。下列说法不正确的是(图中表示链延长)()A.聚合物P中有酯基,能水解B.聚合物P的合成反应为缩聚反应C.聚合物P的原料之一丙三醇可由油脂水解获得D.邻苯二甲酸和乙二醇在聚合过程中也可形成类似聚合物P的交联结构5.(6分)下列除杂试剂选用正确且除杂过程不涉及氧化还原反应的是()物质(括号内为杂质)除杂试剂AFeCl2溶液(FeCl3)Fe粉BNaCl溶液(MgCl2)NaOH溶液、稀HClCCl2(HCl)H2O、浓H2SO4DNO(NO2)H2O、无水CaCl2A.AB.BC.CD.D6.(6分)探究草酸(H2C2O4)性质,进行如下实验。(已知:室温下,0.1mol•L﹣1H2C2O4的pH=1.3)实验装置试剂a现象①Ca(OH)2溶液(含酚酞)溶液褪色,产生白色沉淀②少量NaHCO3溶液产生气泡③酸性KMnO4溶液紫色溶液褪色④C2H5OH和浓硫酸加热后产生有香味物质由上述实验所得草酸性质所对应的方程式不正确的是()A.H2C2O4有酸性,Ca(OH)2+H2C2O4═CaC2O4↓+2H2OB.酸性:H2C2O4>H2CO3,NaHCO3+H2C2O4═NaHC2O4+CO2↑+H2OC.H2C2O4有还原性,2MnO4﹣+5C2O42+16H+═2Mn2++10CO2↑+8H2OD.H2C2O4可发生酯化反应,HOOCCOOH+2C2H5OHC2H5OOCCOOC2H5+2H2O7.(6分)实验测得0.5mol•L﹣1CH3COONa溶液、0.5mol•L﹣1CuSO4溶液以及H2O的pH随温度变化的曲线如图所示。下列说法正确的是()A.随温度升高,纯水中c(H+)>c(OH﹣)B.随温度升高,CH3COONa的溶液...