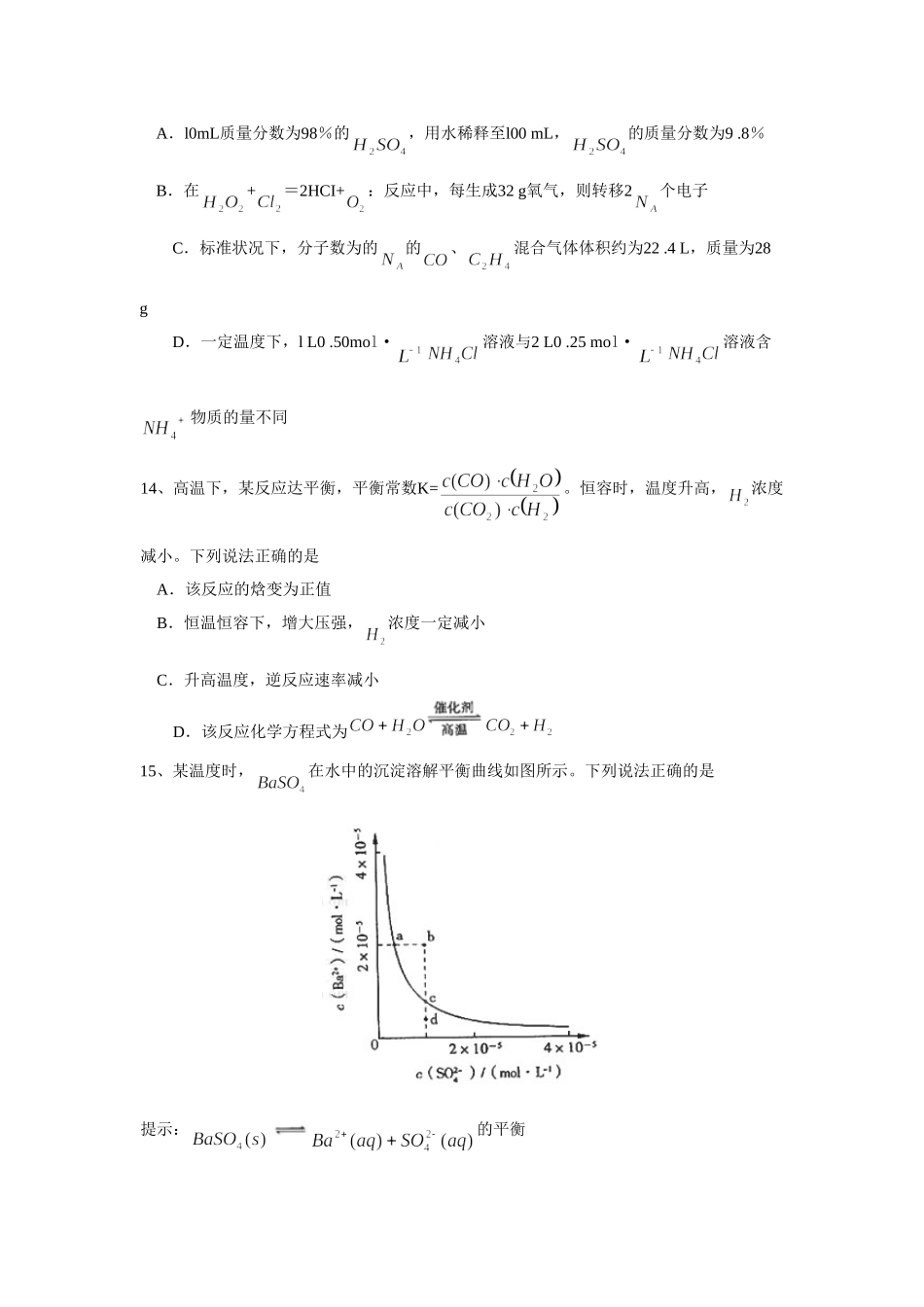
2008年普通高等学校招生全国统一考试(山东卷)理科综合能力测试化学部分第Ⅰ卷以下数据可供答题时参考:相对原于质量(原子量):HlCl2N14O16Na23S32C135.5一、选择题9、下列叙述合理的是A.金属材料都是导体,非金属材料都是绝缘体B.棉、麻、丝、毛及合成纤维完全燃烧都只生成和C.水电站把机械能转化成电能,而核电站把化学能转化成电能D.我国规定自2008年6月1日起,商家不得无偿提供塑料袋,目的是减少“白色污染”10、下列由事实得出的结论错误的是A.维勒用无机物合成了尿素,突破了无机物与有机物的界限B、门捷列夫在前人工作的基础上发现了元素周期律,表明科学研究既要继承又要创新C、是英国和美国化学家共同发现的,体现了国际科技合作的重要性D、科恩和波普尔因理论化学方面的贡献获诺贝尔化学奖,意味着化学已成为以理论研究为主的学科11、下列说法正确的是A.比.稳定B.半径比的小C.Na和Cs属于第ⅠA族元素,Cs失电子能力比Na的强D.P和As属于第ⅤA族元素,酸性比的弱12、下列叙述正确的是A.汽油、柴油和植物油都是碳氢化合物B.乙醇可以被氧化为乙酸,二者都能发生酯化反应C.甲烷、乙烯和苯在工业上都可通过石油分馏得到D.含5个碳原子的有机物.每个分子中最多可形成4个C—C单键13、代表阿伏加德罗常数,下列叙述错误的是A.l0mL质量分数为98%的,用水稀释至l00mL,的质量分数为9.8%B.在+=2HCI+:反应中,每生成32g氧气,则转移2个电子C.标准状况下,分子数为的的、混合气体体积约为22.4L,质量为28gD.一定温度下,lL0.50mol·溶液与2L0.25mol·溶液含物质的量不同14、高温下,某反应达平衡,平衡常数K=。恒容时,温度升高,浓度减小。下列说法正确的是A.该反应的焓变为正值B.恒温恒容下,增大压强,浓度一定减小C.升高温度,逆反应速率减小D.该反应化学方程式为15、某温度时,在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是提示:的平衡常数称为溶度积常数A.加入可以使溶液由a点变到b点B.通过蒸发可以使溶液由d点变到c点C.d点无沉淀生成D.a点对应的大于c点对应的第Ⅱ卷28、(14分)黄铜矿()是制取铜及其化合物的主要原料之一,还可制备硫及铁的化合物。(1)冶炼铜的反应为若中Fe的化合价为+2,反应中被还原的元素是(填元素符号)。(2)上述冶炼过程产生大量。下列处理方案中合理的是(填代号)。a.高空排放b.用于制备硫酸c.用纯碱溶液吸收制d.用浓硫酸吸收(3)过二硫酸钾()具有强氧化性,可将...