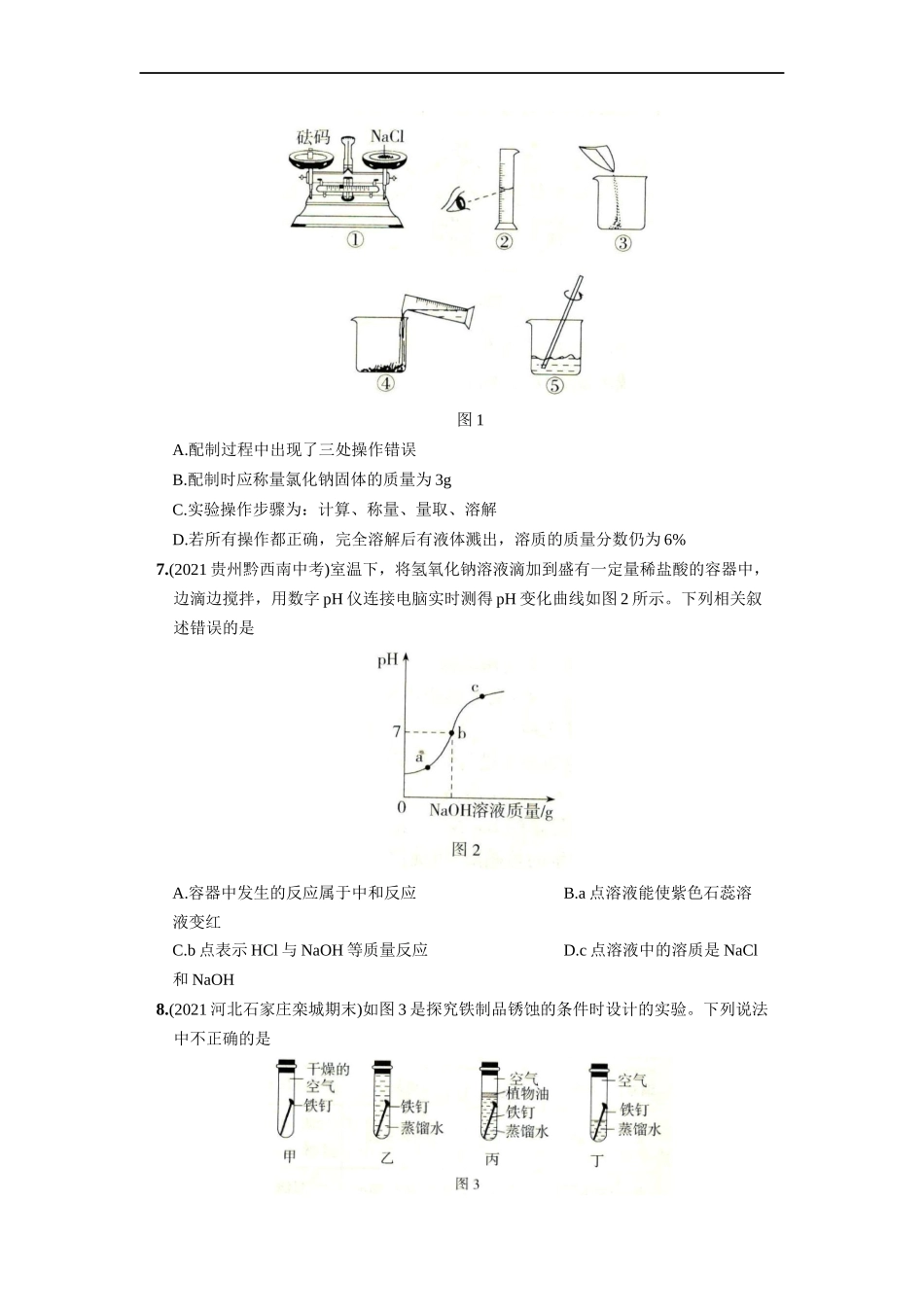
九年级化学下册结业测试(二)〔满分:100分限时:60分钟〕一、选择题(每小题3分,共39分)1.(2021独家原创试题)2021年7月1日天安门上空,一面鲜艳的党旗在高空迎风飞过,绽放庄严之美。旗面使用的是一种高强锦丝绸的有机合成材料。下列属于有机合成材料的是A.塑料B.铝合金C.羊毛D.玻璃钢2.(2021重庆中考A卷)叶子发黄的水稻易倒伏,专家建议施用含钾的复合肥料。下列肥料符合要求的是A.NH4NO3B.KNO3C.NH4H2PO4D.K2SO43.(2021独家原创试题)2021年6月28日,我国“科学”号科考船完成首个高端用户共享航次,在目标海域获得大量科学发现。大量金属材料在海洋科研中得到了应用,下列有关金属的说法错误的是A.生铁和钢是含碳量不同的两种铁合金B.钢铁在海水中易锈蚀C.金的化学性质很不活泼,在自然界中有单质的形式存在D.铜的导电性比银强,所以常用作导线4.(2021湖南长沙岳麓二模)下列说法错误的是A.饱和溶液不一定是浓溶液B.汽水、牛奶都是溶液C.洗洁精去油污是因为洗洁精具有乳化功能D.溶液都是均一、稳定的混合物5.(2021甘肃白银中考)“吃出营养、吃出健康”是人们普遍的饮食追求。下列说法不正确的是A.不吃霉变或超过保质期的食物B.人体缺乏维生素A会引起夜盲症C.食用甲醛浸泡的食物会危害人体健康D.微量元素对人体十分重要,应该大量服用6.(2021山东潍坊一模)某同学需要配制50g质量分数为6%的氯化钠溶液,步骤如图1所示,下列分析不正确的是图1A.配制过程中出现了三处操作错误B.配制时应称量氯化钠固体的质量为3gC.实验操作步骤为:计算、称量、量取、溶解D.若所有操作都正确,完全溶解后有液体溅出,溶质的质量分数仍为6%7.(2021贵州黔西南中考)室温下,将氢氧化钠溶液滴加到盛有一定量稀盐酸的容器中,边滴边搅拌,用数字pH仪连接电脑实时测得pH变化曲线如图2所示。下列相关叙述错误的是A.容器中发生的反应属于中和反应B.a点溶液能使紫色石蕊溶液变红C.b点表示HCl与NaOH等质量反应D.c点溶液中的溶质是NaCl和NaOH8.(2021河北石家庄栾城期末)如图3是探究铁制品锈蚀的条件时设计的实验。下列说法中不正确的是A.一周后,只有丁实验铁钉生锈明显B.甲和丁对比实验,探究的是水对铁生锈的影响C.乙和丙对比实验,探究的是空气对铁生锈的影响D.丙和丁对比实验,探究的是空气对铁生锈的影响9.(2021广东深圳龙华二模)如图4表示Na2CO3与不同类别物质之间的性质关系(“-”表示相连物质能发生反应,“→”表示两种物质间的转化关系,部分物质和反应条件已略去)。下...