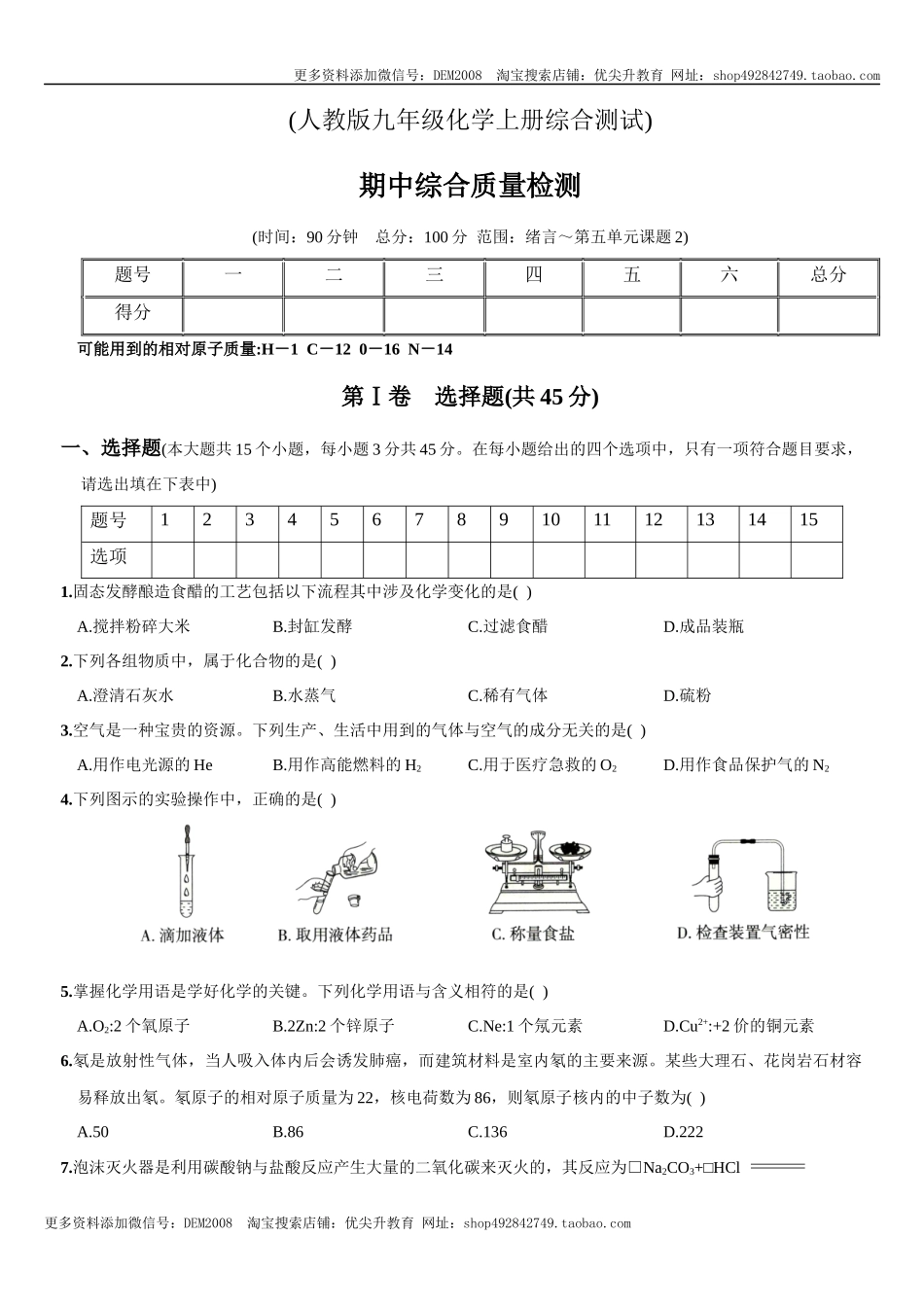
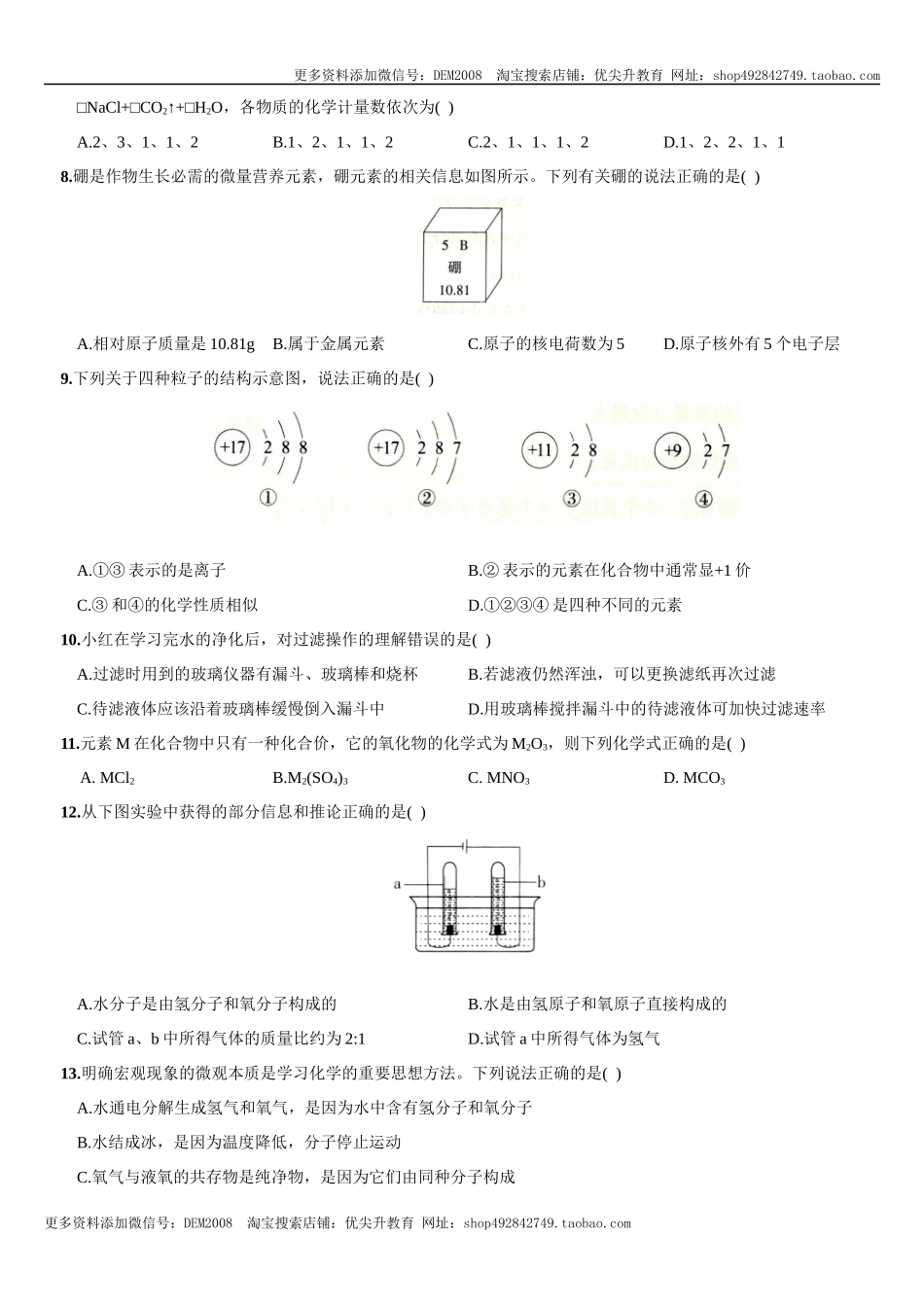
更多资料添加微信号:DEM2008淘宝搜索店铺:优尖升教育网址:shop492842749.taobao.com更多资料添加微信号:DEM2008淘宝搜索店铺:优尖升教育网址:shop492842749.taobao.com(人教版九年级化学上册综合测试)期中综合质量检测(时间:90分钟总分:100分范围:绪言~第五单元课题2)题号一二三四五六总分得分可能用到的相对原子质量:H-1C-120-16N-14第Ⅰ卷选择题(共45分)一、选择题(本大题共15个小题,每小题3分共45分。在每小题给出的四个选项中,只有一项符合题目要求,请选出填在下表中)题号123456789101112131415选项1.固态发酵酿造食醋的工艺包括以下流程其中涉及化学变化的是()A.搅拌粉碎大米B.封缸发酵C.过滤食醋D.成品装瓶2.下列各组物质中,属于化合物的是()A.澄清石灰水B.水蒸气C.稀有气体D.硫粉3.空气是一种宝贵的资源。下列生产、生活中用到的气体与空气的成分无关的是()A.用作电光源的HeB.用作高能燃料的H2C.用于医疗急救的O2D.用作食品保护气的N24.下列图示的实验操作中,正确的是()5.掌握化学用语是学好化学的关键。下列化学用语与含义相符的是()A.O2:2个氧原子B.2Zn:2个锌原子C.Ne:1个氖元素D.Cu2+:+2价的铜元素6.氡是放射性气体,当人吸入体内后会诱发肺癌,而建筑材料是室内氡的主要来源。某些大理石、花岗岩石材容易释放出氡。氡原子的相对原子质量为22,核电荷数为86,则氡原子核内的中子数为()A.50B.86C.136D.2227.泡沫灭火器是利用碳酸钠与盐酸反应产生大量的二氧化碳来灭火的,其反应为□Na2CO3+□HCl=更多资料添加微信号:DEM2008淘宝搜索店铺:优尖升教育网址:shop492842749.taobao.com更多资料添加微信号:DEM2008淘宝搜索店铺:优尖升教育网址:shop492842749.taobao.com□NaCl+□CO2↑+□H2O,各物质的化学计量数依次为()A.2、3、1、1、2B.1、2、1、1、2C.2、1、1、1、2D.1、2、2、1、18.硼是作物生长必需的微量营养元素,硼元素的相关信息如图所示。下列有关硼的说法正确的是()A.相对原子质量是10.81gB.属于金属元素C.原子的核电荷数为5D.原子核外有5个电子层9.下列关于四种粒子的结构示意图,说法正确的是()A.①③表示的是离子B.②表示的元素在化合物中通常显+1价C.③和④的化学性质相似D.①②③④是四种不同的元素10.小红在学习完水的净化后,对过滤操作的理解错误的是()A.过滤时用到的玻璃仪器有漏斗、玻璃棒和烧杯B.若滤液仍然浑浊,可以更换滤纸再次过滤C.待滤液体应该沿着玻璃棒缓慢倒入漏斗中D.用玻璃棒搅拌...