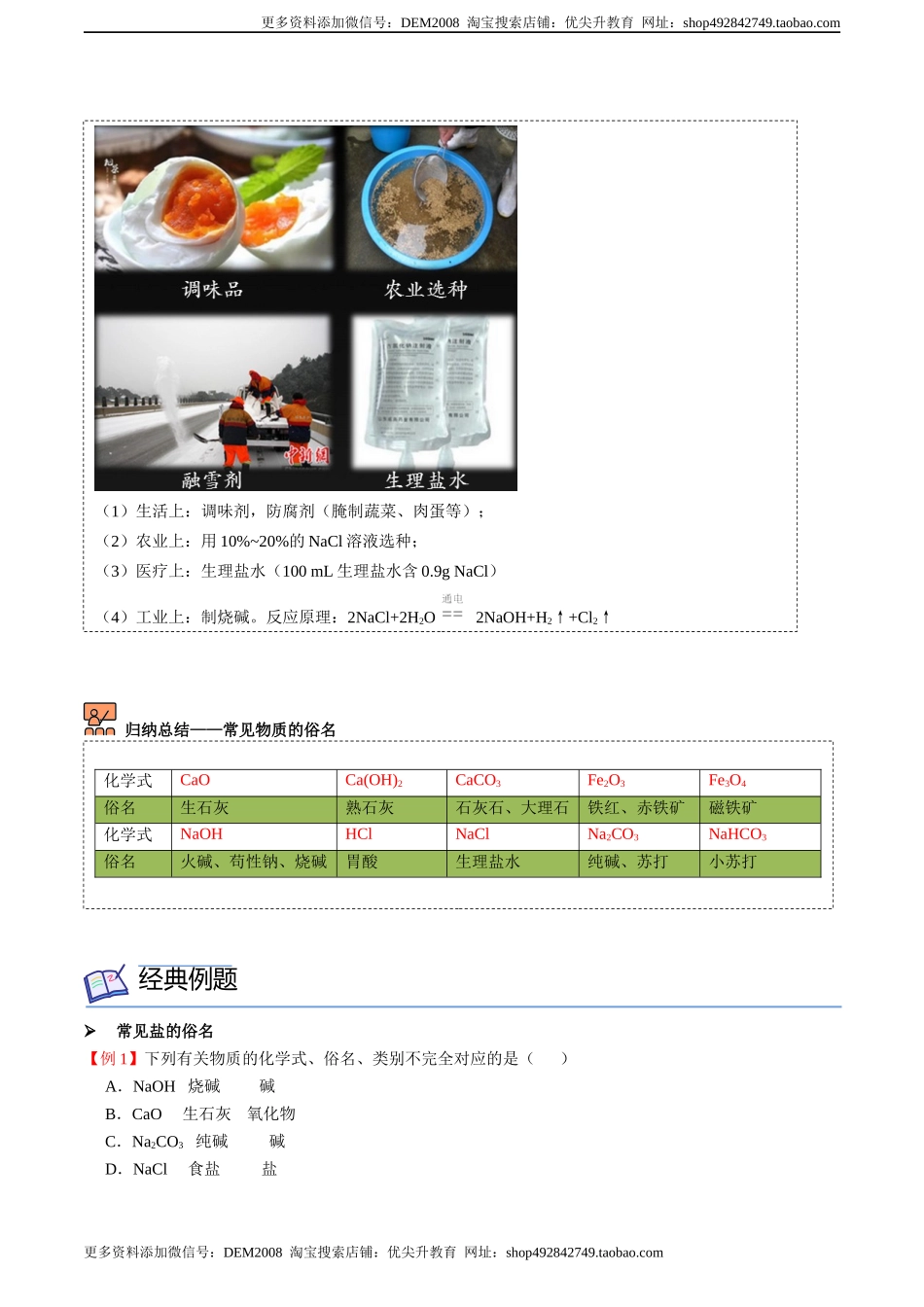
更多资料添加微信号:DEM2008淘宝搜索店铺:优尖升教育网址:shop492842749.taobao.com更多资料添加微信号:DEM2008淘宝搜索店铺:优尖升教育网址:shop492842749.taobao.com第九讲常见的盐1.简单回顾盐的含义盐:指一类组成里含有金属离子(或NH4+)和酸根离子的化合物。盐的命名:①‘某化某’:如NaCl—氯化钠,写出名字KCl:;AgCl:;②‘某酸某’:如Na2CO3—碳酸钠,写出名字CaCO3:;BaSO4:;【答案】①氯化钾,氯化银;②碳酸钙,硫酸钡;思考与交流【答案】(1)HCl、H2SO4、H2CO3;(2)NaOH、Ca(OH)2、Cu(OH)2、NH3•H2O;(3)CaCO3、NaCl、Na2CO3、NaHCO3。2.生活中常见的盐氯化钠碳酸钠碳酸氢钠碳酸钙化学式NaClNa2CO3NaHCO3CaCO3模块一常见的盐的用途知识精讲1.下列物质中哪些是酸?哪些是碱?哪些是盐?在下列横线上写上化学式。CaCO3HClNaClNa2CO3NaOHNaHCO3H2SO4Ca(OH)2Cu(OH)2NH3•H2OH2CO3(1)酸:(2)碱:(3)盐:更多资料添加微信号:DEM2008淘宝搜索店铺:优尖升教育网址:shop492842749.taobao.com更多资料添加微信号:DEM2008淘宝搜索店铺:优尖升教育网址:shop492842749.taobao.com俗称苏打、纯碱小苏打石灰石、大理石溶解性(20℃)36g易溶21.2g易溶9.6g可溶0.0013g难溶水溶液的酸碱性中性碱性碱性中性用途调味剂、防腐剂洗涤剂、生产玻璃发酵粉、治疗胃酸过多建筑材料、补钙剂思考与交流【答案】(1)不对,它属于盐;(2)不对,Na2CO3能使酚酞变红,但不是碱;(3)不对,食盐是混合物,NaCl是纯净物;(4)不是,工业盐的成分是NaNO2亚硝酸钠资料卡片——NaCl的用途·(1)Na2CO3俗称纯碱,水溶液呈碱性,它属于碱,对吗?(2)碱性溶液能使无色酚酞溶液变红,则能使酚酞变红的都是碱,对吗?(3)食盐的主要成分是NaCl,则NaCl就是食盐,对吗?(4)有人误食用工业盐而中毒,工业盐和食用盐是同种物质吗?更多资料添加微信号:DEM2008淘宝搜索店铺:优尖升教育网址:shop492842749.taobao.com更多资料添加微信号:DEM2008淘宝搜索店铺:优尖升教育网址:shop492842749.taobao.com归纳总结——常见物质的俗名常见盐的俗名【例1】下列有关物质的化学式、俗名、类别不完全对应的是()A.NaOH烧碱碱B.CaO生石灰氧化物C.Na2CO3纯碱碱D.NaCl食盐盐(1)生活上:调味剂,防腐剂(腌制蔬菜、肉蛋等);(2)农业上:用10%~20%的NaCl溶液选种;(3)医疗上:生理盐水(100mL生理盐水含0.9gNaCl)(4)工业上:制烧碱...