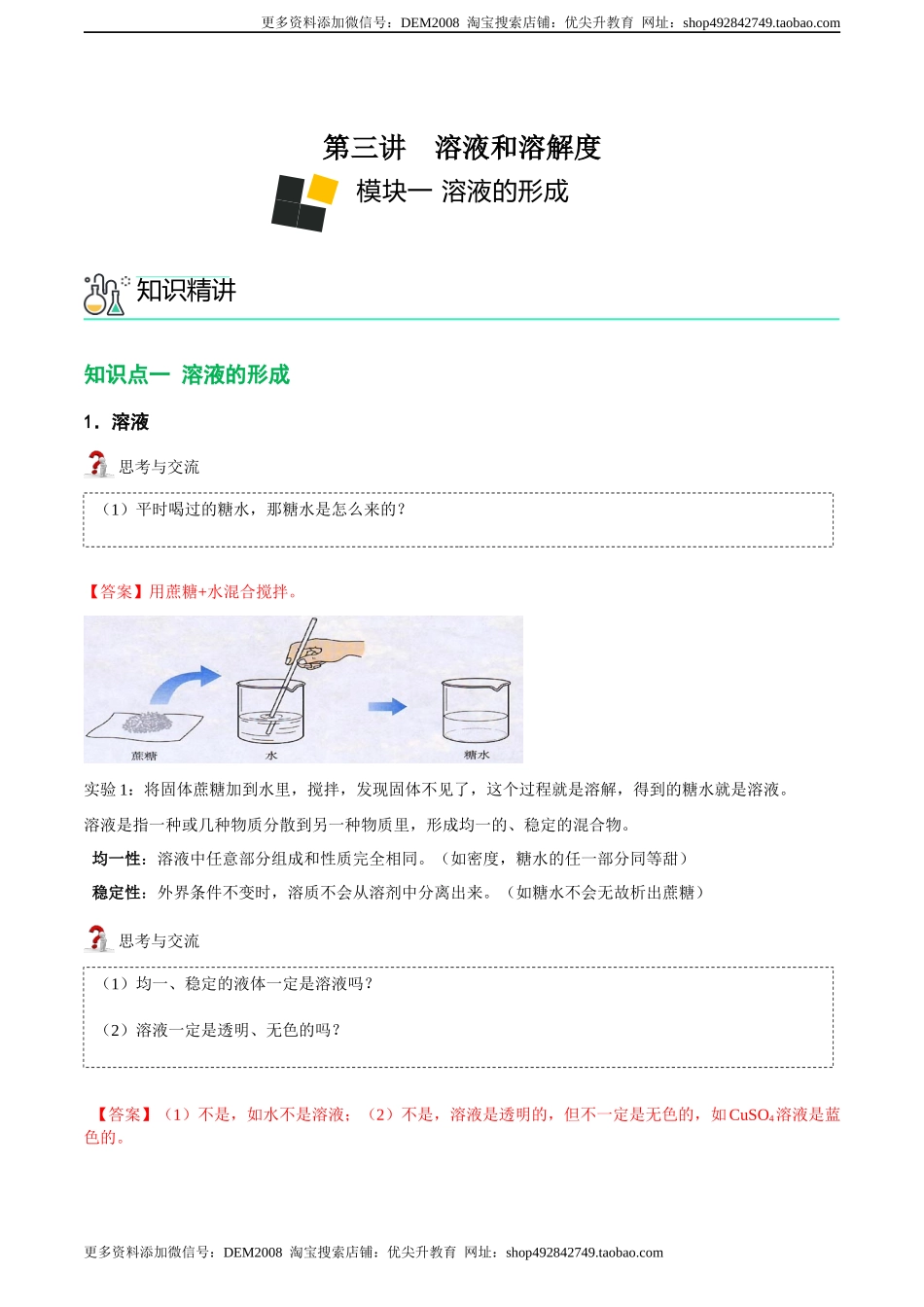
更多资料添加微信号:DEM2008淘宝搜索店铺:优尖升教育网址:shop492842749.taobao.com更多资料添加微信号:DEM2008淘宝搜索店铺:优尖升教育网址:shop492842749.taobao.com第三讲溶液和溶解度知识点一溶液的形成1.溶液思考与交流【答案】用蔗糖+水混合搅拌。实验1:将固体蔗糖加到水里,搅拌,发现固体不见了,这个过程就是溶解,得到的糖水就是溶液。溶液是指一种或几种物质分散到另一种物质里,形成均一的、稳定的混合物。均一性:溶液中任意部分组成和性质完全相同。(如密度,糖水的任一部分同等甜)稳定性:外界条件不变时,溶质不会从溶剂中分离出来。(如糖水不会无故析出蔗糖)思考与交流【答案】(1)不是,如水不是溶液;(2)不是,溶液是透明的,但不一定是无色的,如CuSO4溶液是蓝色的。模块一溶液的形成知识精讲(1)平时喝过的糖水,那糖水是怎么来的?(1)均一、稳定的液体一定是溶液吗?(2)溶液一定是透明、无色的吗?更多资料添加微信号:DEM2008淘宝搜索店铺:优尖升教育网址:shop492842749.taobao.com更多资料添加微信号:DEM2008淘宝搜索店铺:优尖升教育网址:shop492842749.taobao.com判断对错1、冰水混合物是溶液。()2、把食盐溶液倒掉一半后,变稀了。()【答案】××易错提醒1.溶液一般是透明的,但透明不一定无色。如硫酸铜溶液是蓝色的、FeCl2是浅绿色的、FeCl3是黄色的。2.溶液的组成(1)溶液由溶质和溶剂组成。溶剂:能溶解其他物质的物质叫溶剂。溶质:被溶解的物质叫溶质。如:糖水,溶剂是水,溶质是蔗糖。及时小练判断下列溶液中的溶质和溶剂溶液溶质溶剂硫酸铜溶液CuSO4水生理盐水NaCl水酒精溶液酒精水碘酒碘酒精盐酸HCl(氯化氢)水一种溶液里,只能有一种溶质,对吗?【答案】不对,海水中含有NaCl、MgCl2等,但溶剂只有1种。归纳总结1.溶液一定是混合物。因为它是至少由两种物质组成,如硫酸铜溶液由CuSO4与水组成,海水由NaCl、MgCl2等于水组成。2.溶质可能有几种,但溶剂只有一种。3.溶质和溶剂的判断①一般习惯将固体或气体看作溶质,液体看作为溶剂。如食盐水中氯化钠是溶质,水是溶剂;碘酒中碘是溶质,酒精是溶剂。更多资料添加微信号:DEM2008淘宝搜索店铺:优尖升教育网址:shop492842749.taobao.com更多资料添加微信号:DEM2008淘宝搜索店铺:优尖升教育网址:shop492842749.taobao.com②若是由两种液体组成的溶液,一般习惯上把量多的看作为溶剂,量少的看作为溶质。③水是最常用的...