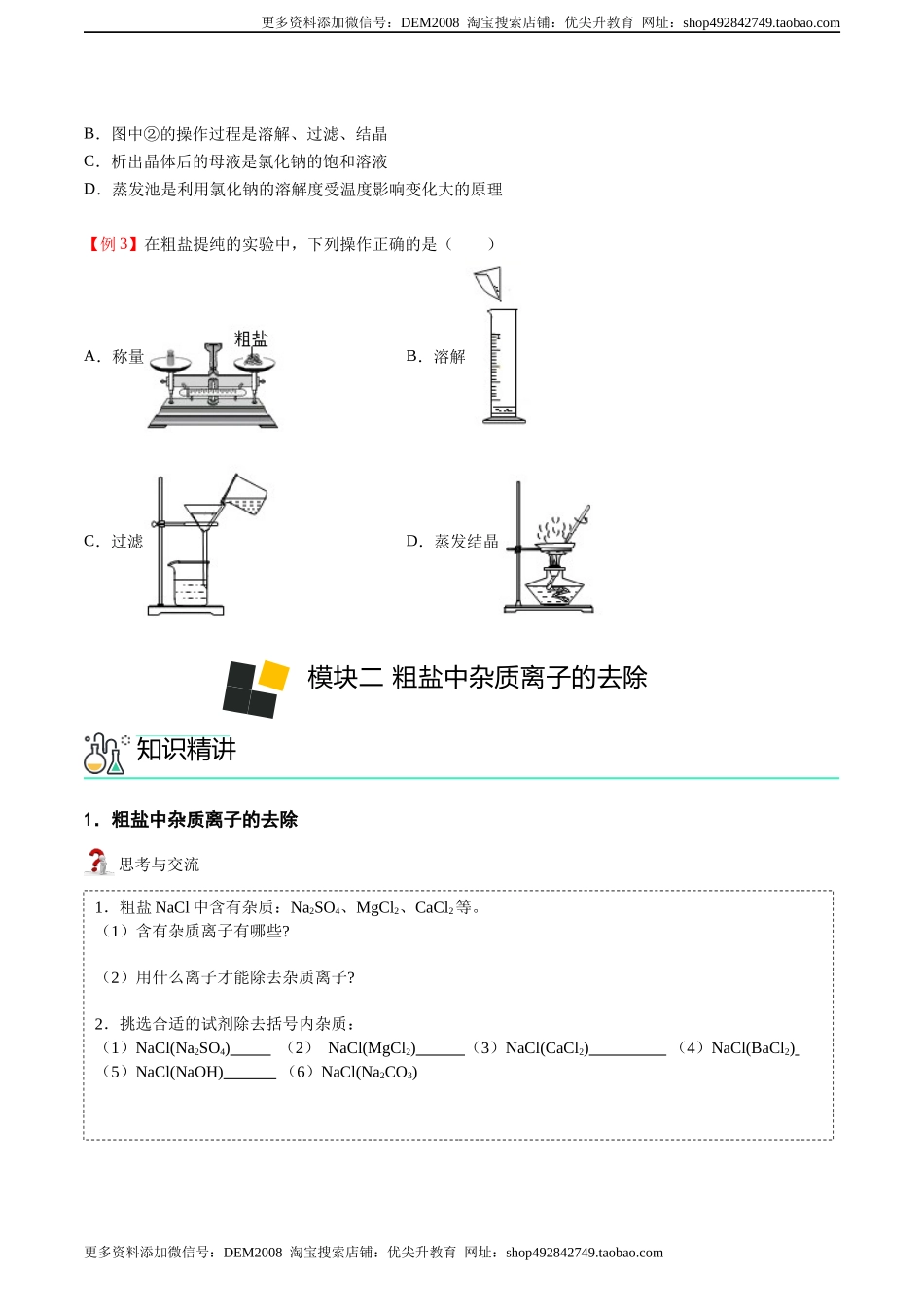
更多资料添加微信号:DEM2008淘宝搜索店铺:优尖升教育网址:shop492842749.taobao.com更多资料添加微信号:DEM2008淘宝搜索店铺:优尖升教育网址:shop492842749.taobao.com第十一讲粗盐的提纯1.粗盐的提纯实验用海水晒盐,得到粗盐NaCl:粗盐中主要成分是食盐,主要含有的杂质:①难溶性杂质:泥沙等;②可溶性杂质:Na2SO4、MgCl2、CaCl2等。实验步骤操作示意图操作方法玻璃棒的作用溶解称取5.0克粗盐,用量简量取10毫升水,将粗盐和水倒入烧杯里,用玻璃棒搅拌使粗盐溶解充分过滤将烧杯中的液体沿玻璃棒倒入过滤装置中,其液面不能超过滤纸边缘,若滤液浑浊,再过滤一次蒸发将滤液倒入蒸发皿中,然后用酒精灯加热,同时用玻璃棒不断搅溶液,待出现较多固体时停止加热模块一粗盐提纯的基本实验知识精讲更多资料添加微信号:DEM2008淘宝搜索店铺:优尖升教育网址:shop492842749.taobao.com更多资料添加微信号:DEM2008淘宝搜索店铺:优尖升教育网址:shop492842749.taobao.com计算产率用玻璃棒把固体转移到纸上,用托盘天平称量质量并记录,比较提纯前后食盐状态并计算精盐的产率=×100%思考与交流粗盐中难溶性杂质的去除实验【例1】(2020·广东广州)已知室温下NaCl的溶解度约为36g。现称取3.6g粗盐,经过溶解、过滤、蒸发、转移等步骤,除去泥沙得到精盐。下列操作正确且合理的是()A.溶解B.过滤C.蒸发D.转移【例2】(2018·广东)如图是利用海水提取粗盐的过程,下列说法中错误的是()A.图中①是结晶池(1)过滤时,‘一贴二低三靠’指什么?(2)蒸发时,一直蒸干液体才停止加热,对吗?(3)这样提纯的食盐是否为纯净物?经典例题更多资料添加微信号:DEM2008淘宝搜索店铺:优尖升教育网址:shop492842749.taobao.com更多资料添加微信号:DEM2008淘宝搜索店铺:优尖升教育网址:shop492842749.taobao.comB.图中②的操作过程是溶解、过滤、结晶C.析出晶体后的母液是氯化钠的饱和溶液D.蒸发池是利用氯化钠的溶解度受温度影响变化大的原理【例3】在粗盐提纯的实验中,下列操作正确的是()A.称量B.溶解C.过滤D.蒸发结晶1.粗盐中杂质离子的去除思考与交流模块二粗盐中杂质离子的去除知识精讲1.粗盐NaCl中含有杂质:Na2SO4、MgCl2、CaCl2等。(1)含有杂质离子有哪些?(2)用什么离子才能除去杂质离子?2.挑选合适的试剂除去括号内杂质:(1)NaCl(Na2SO4)(2)NaCl(MgCl2)(3)NaCl(CaCl2)(4)NaCl(BaCl2)(5)NaCl(NaOH)(...