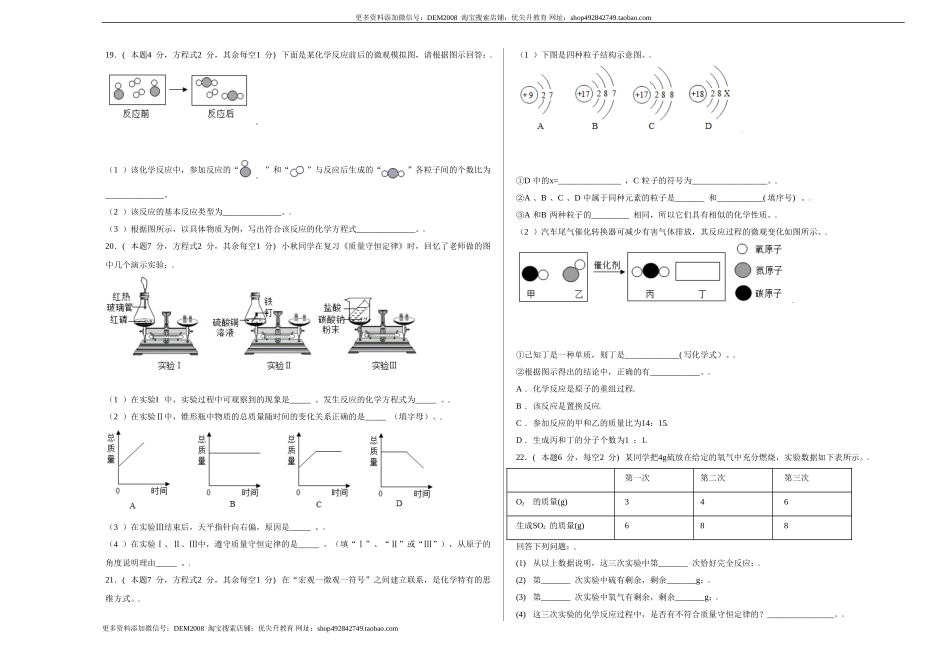
更多资料添加微信号:DEM2008淘宝搜索店铺:优尖升教育网址:shop492842749.taobao.com绝密★启用前|学科网考试研究中心命制第五单元综合检查化学一、选择题(本大题共15小题,每小题2分,共30分.在每小题给出的四个选项中,只有一个选项是符合题目要求的)一、单选题(共30分)1.下列叙述完全符合质量守恒定律的是A.水结成冰前后,质量保持不变B.50mL水和50mL乙醇混合后总体积小于100mLC.在100g30%过氧化氢溶液中,含有30g过氧化氢和70g水D.1.2g碳与3.2g氧气恰好完全反应可生成4.4g二氧化碳2.质量守恒定律是帮助我们认识化学反应实质的重要理论。在化学反应aA+bB=cC+dD中,下列说法正确的是A.化学计量数a与b之和一定等于c与d之和B.若取xgA和xgB反应,生成C和D的质量总和不一定是2xgC.反应物A和B的质量比一定等于生成物C和D的质量比D.该反应是分解反应3.下列现象不能用质量守恒定律解释的是A.木材燃烧,余下灰烬的质量小于原木材质量B.铜丝在火焰上灼烧,灼烧后的“铜丝”质量增加C.加热高锰酸钾,剩余固体质量减少D.将一定质量的水冷凝后结成冰,质量不变4.酸性高锰酸钾溶液可测室内甲醛的含量是否超标。相关反应方程式是,其中X的化学式为A.CO2B.COC.H2CO3D.K2CO35.四位同学正在讨论某一个化学方程式的意义,他们所描述的化学方程式是A.B.C.D.6.在电解水的反应前后,下列各项中肯定没有发生变化的是①原子总数目②水分子数目③氢、氧元素种类④物质的总质量⑤物质种类⑥原子的种类A.①③⑤B.①④⑥C.①③④⑥D.①③④⑤⑥7.一定条件下,下列物质在密闭容器内反应一段时间,测得反应前后各物质的质量如下:物质XYZW反应前质量/g102.216.20.9反应后质量/ga4.413.11.8根据上表信息判断,下列说法中不正确的是A.该反应为分解反应B.a=10,X一定是催化剂C.反应中Y、W两种物质变化的质量比为22︰9D.该反应符合质量守恒定律更多资料添加微信号:DEM2008淘宝搜索店铺:优尖升教育网址:shop492842749.taobao.com更多资料添加微信号:DEM2008淘宝搜索店铺:优尖升教育网址:shop492842749.taobao.com8.清华大学研究人员成功研制出一种纳米纤维催化剂,可将二氧化碳转化成液体燃料甲醇,其微观示意图如下(图中的微粒恰好完全反应)。下列说法正确的是A.丁的化学式为H2O2B.参加反应的甲与乙的质量比为3∶1C.甲是单质,乙、丙、丁均为氧化物D.该反应遵守质量守恒定律9.常用燃烧法测定有机物的组成。现取2.3g某有机物...