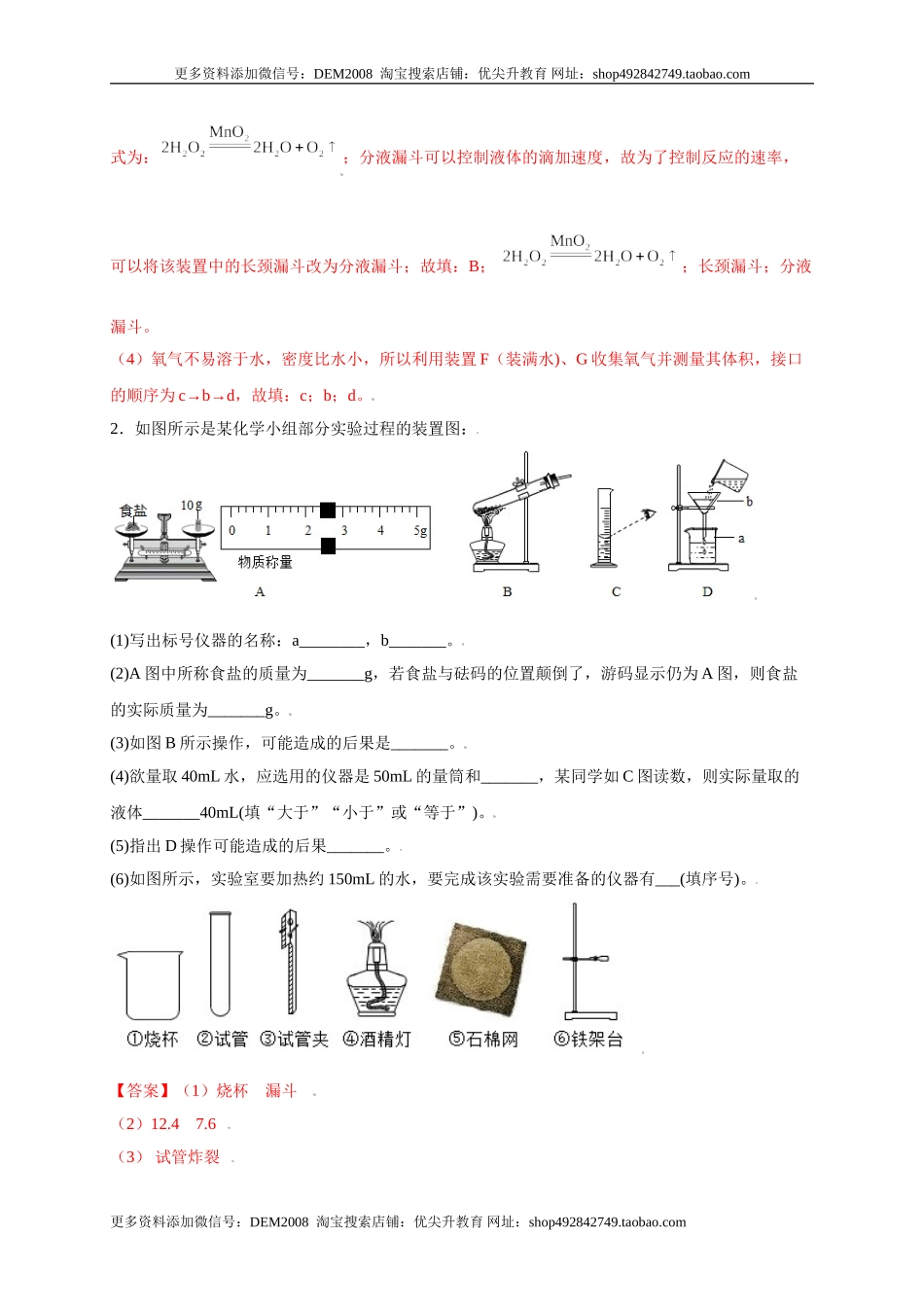
更多资料添加微信号:DEM2008淘宝搜索店铺:优尖升教育网址:shop492842749.taobao.com期末总复习考点必杀200题专练04(重点实验15题)1.根据下图回答问题(1)写出仪器的名称:④______;⑤______;(2)实验室用氯酸钾和二氧化锰作为原料制取氧气,选择的发生装置是______;发生反应的化学方程式:______;(3)如果用过氧化氢溶液制取氧气可以选用的发生装置是______,则发生反应的化学方程式为______;为了控制反应的速率,可以将该装置中的______改为______。(4)利用装置F(装满水)、G收集氧气并测量其体积,则接口的顺序为(填b、c、d):______→______→______。【答案】(1)锥形瓶水槽(2)A(3)B长颈漏斗分液漏斗(4)cbd【解析】(1)仪器的名称:④锥形瓶,⑤水槽;故填:锥形瓶,水槽。(2)实验室用氯酸钾制取氧气的反应物是固体,反应条件是加热,选择固固加热型装置,所以选择的发生装置是A,氯酸钾在二氧化锰的催化作用下分解生成氯化钾和氧气,化学方程式为:,故填:A,(3)实验室用过氧化氢制取氧气的反应物是液体,反应条件是常温、催化剂,选择固液不加热型装置,所以可以选用的发生装置是B,过氧化氢在二氧化锰的催化作用下生成水和氧气,化学方程更多资料添加微信号:DEM2008淘宝搜索店铺:优尖升教育网址:shop492842749.taobao.com更多资料添加微信号:DEM2008淘宝搜索店铺:优尖升教育网址:shop492842749.taobao.com式为:;分液漏斗可以控制液体的滴加速度,故为了控制反应的速率,可以将该装置中的长颈漏斗改为分液漏斗;故填:B;;长颈漏斗;分液漏斗。(4)氧气不易溶于水,密度比水小,所以利用装置F(装满水)、G收集氧气并测量其体积,接口的顺序为c→b→d,故填:c;b;d。2.如图所示是某化学小组部分实验过程的装置图:(1)写出标号仪器的名称:a________,b_______。(2)A图中所称食盐的质量为_______g,若食盐与砝码的位置颠倒了,游码显示仍为A图,则食盐的实际质量为_______g。(3)如图B所示操作,可能造成的后果是_______。(4)欲量取40mL水,应选用的仪器是50mL的量筒和_______,某同学如C图读数,则实际量取的液体_______40mL(填“大于”“小于”或“等于”)。(5)指出D操作可能造成的后果_______。(6)如图所示,实验室要加热约150mL的水,要完成该实验需要准备的仪器有___(填序号)。【答案】(1)烧杯漏斗(2)12.47.6(3)试管炸裂更多资料添加微信号:DEM2008淘宝搜索店铺:优尖升教育网址:sho...