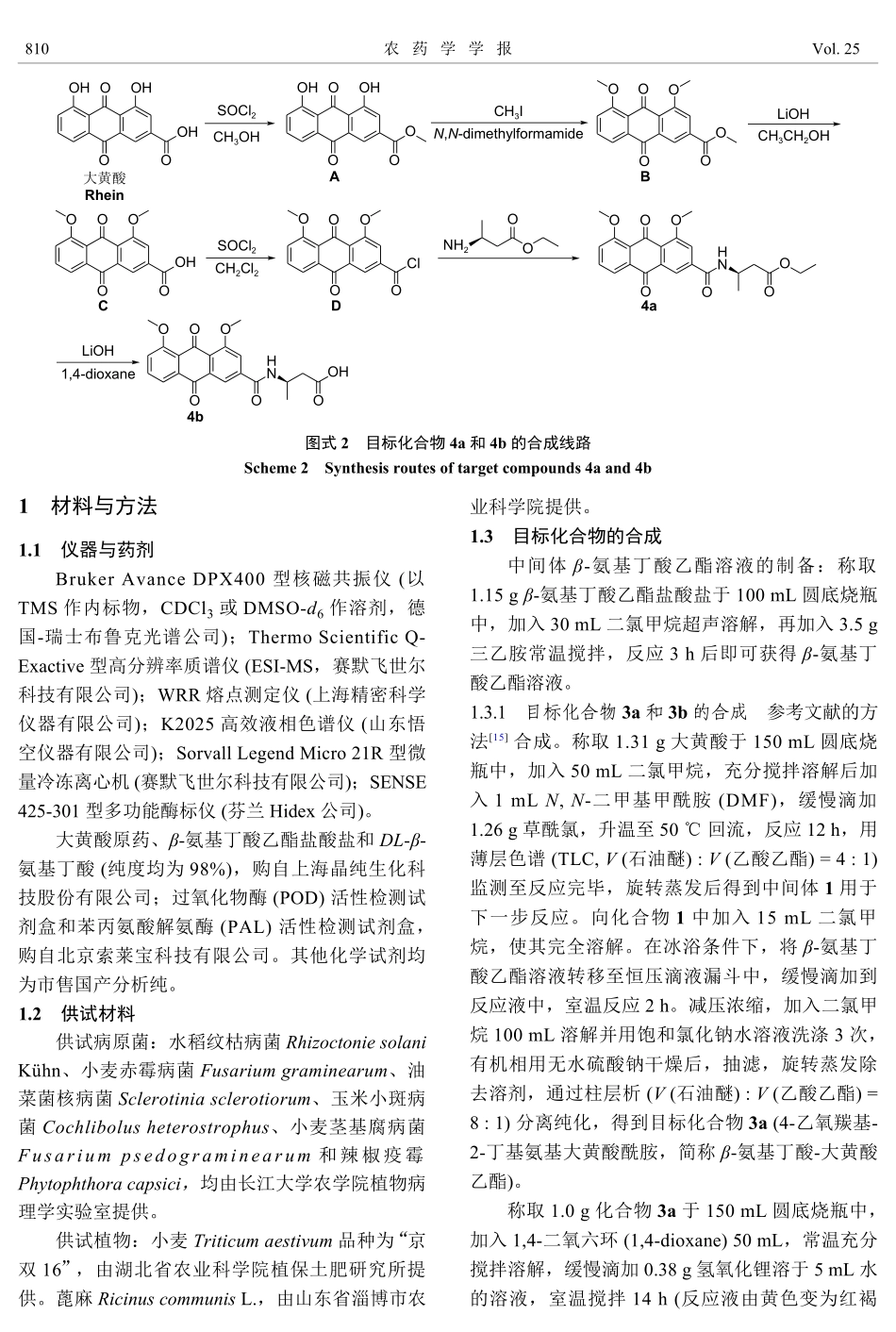
•研究论文•doi:10.16801/j.issn.1008-7303.2023.0036β-氨基丁酸-大黄酸耦合物的合成、生物活性及韧皮部传导性胡慈银#,1,王锦鹏#,1,肖永欣1,李俊凯*,1,2(1.长江大学农学院,湖北荆州434025;2.长江大学农药研究所,湖北荆州434025)摘要:氨基酸-农药耦合物能够改善母体农药的内吸传导性,提高农药的使用效率,减少因没有到达靶标造成的浪费及对环境的污染。本研究以天然产物大黄酸为先导化合物、以β-氨基丁酸为导向基团,设计、合成了4个目标化合物,并检测了其对6种植物病原菌的抑菌活性,以及对小麦植株苯丙氨酸解氨酶(PAL)和过氧化物酶(POD)活性的影响及在蓖麻幼苗中的韧皮部传导性。结果表明,化合物4b(浓度0.5mmol/L)不仅对水稻纹枯病菌RhizoctoniasolaniKühn具有一定的抑制活性(菌丝生长抑制率为53.5%),而且具有诱导抗性(持效期近7d)和韧皮部传导性(渗出液浓度为15.1μmol/L)。该研究为兼具内吸传导性和诱导抗性杀菌剂的开发提供了新思路。关键词:β-氨基丁酸-大黄酸耦合物;抑菌活性;诱导抗性;韧皮部传导性中图分类号:O626.2;TQ455.4文献标志码:ASynthesisofβ-aminobutyricacid-RheinconjugatesandtheirbioactivityandphloemtranslocationHUCiyin#,1,WANGJinpeng#,1,XIAOYongxin1,LIJunkai*,1,2(1.SchoolofAgriculture,YangtzeUniversity,Jingzhou434025,HubeiProvince,China;2.Instituteofpesticides,YangtzeUniversity,Jingzhou434025,HubeiProvince,China)Abstract:Amino-pesticideconjugatesenabletoimprovethesystemicconductivityofparentingredients,increaseutilizationefficiency,anddecreasethewastethatwascausedbytheunreachedtargetandthuspollutiontotheenvironment.Inthisstudy,fourtargetcompoundsweredesignedandsynthesizedusingthenaturalproductRheinastheleadingcompoundandβ-aminobutyricacid(BABA)asthedirectinggroup,andtheirantifungalactivitiesagainstthesixplantpathogens,effectsonenzymaticactivitiesofthephenylalanineammonialyase(PAL)andperoxidase(POD)ofwheatleaves,whichweretreatedbythecompounds,andtheirphloemtranslocationinRicinusseedlingweremeasured.Theresultsshowedthatcompound4b(concentrationat0.5mmol/L)hadnotonlyaninhibitioneffectontheRhizoctoniasolaniKühn(theinhibitionrateofmycelialgrowthwas53.5%),butalsoaninducibleresistance(durationwasnearly7d),andphl...