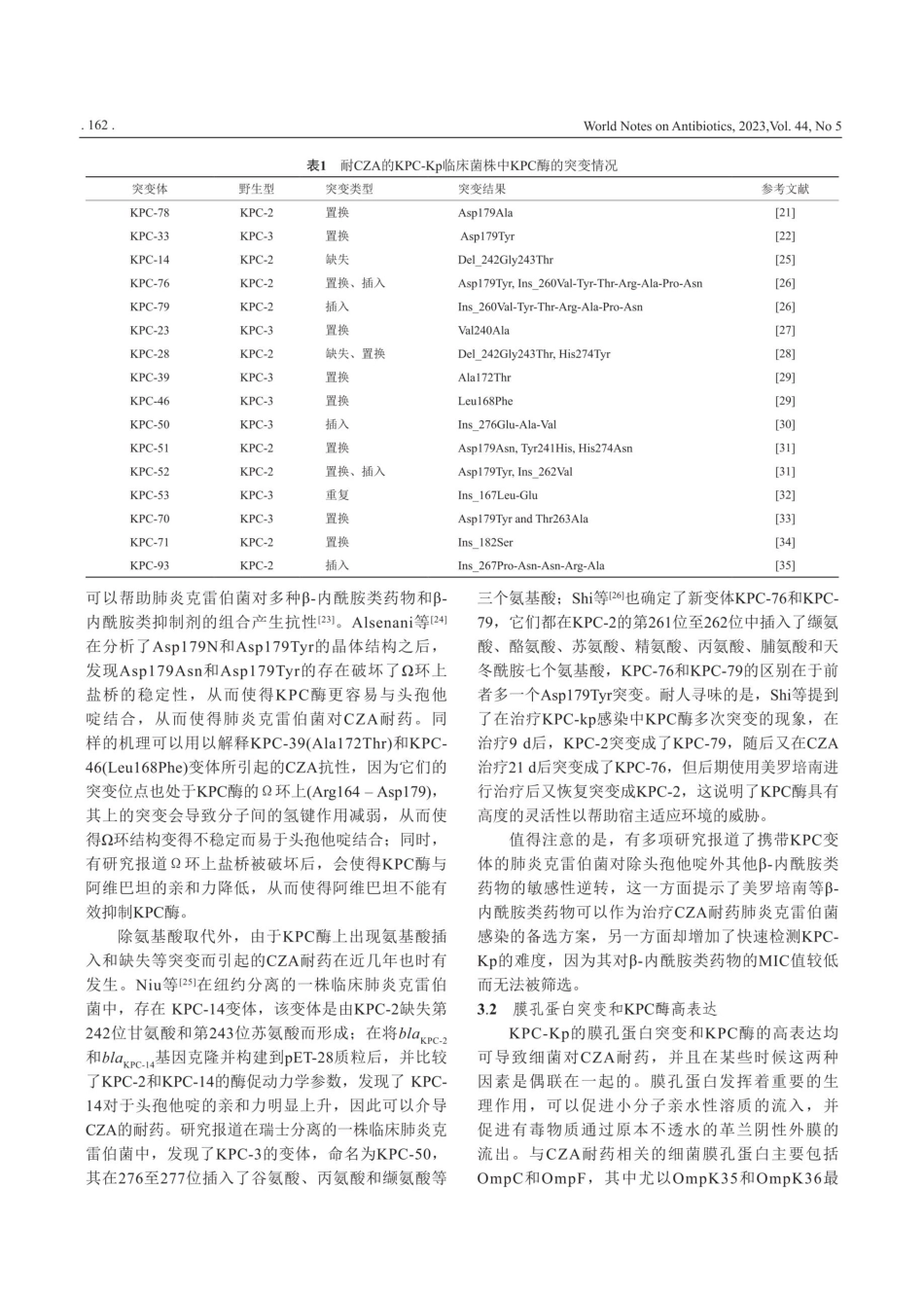
.160.WorldNotesonAntibiotics,2023,Vol.44,No5产KPC酶肺炎克雷伯菌对头孢他啶/阿维巴坦耐药机制研究进展郑媚",匡徐",李甫豪,冯可莹²,于洋1(1华南农业大学,广州510642;2菲鹏生物股份有限公司,东莞523808)摘要:头孢他啶/阿维巴坦(Ceftazidime/Avibactam,CZA)是头孢他啶和一种新型β-内酰胺酶抑制剂(阿维巴坦)的组合,已被美国食品药品监督管理局和国家市场监督管理总局批准,主要用于治疗复杂的腹部和尿道感染、医院获得性细菌性肺炎和呼吸机相关的细菌性肺炎,特别是由肺炎克雷伯菌引起的感染和炎症。然而,CZA临床应用导致了多重耐药肺炎克雷伯菌的出现。其耐药机制主要有三种:blakpc基因的突变、细菌细胞膜孔蛋白突变和KPC酶的表达量增加。本文就耐CZA的肺炎克雷伯菌流行情况和耐药机制进行综述,旨在为临床防治CZA的耐药菌株提供科学依据,并为新药开发提供指导。关键词:产KPC酶肺炎克雷伯菌;头孢他啶;阿维巴坦;耐药机制;作用机理;突变中图分类号:R978.1文献标志码:A文章编号:1001-8751(2023)03-0160-06ResearchProgressontheResistanceMechanismofKPC-ProducingKlebsiellapneumoniaetoCeftazidime/AvibactamZhengMeil,KuangXu',LiFu-hao',FengKe-ying’,YuYang'(1SouthChinaAgriculturalUniversity,Guangzhou510642;2FeipengBiotechnologyCo.,Ltd,Dongguan523808)Abstract:Ceftazidime/avibactam(CZA)isacombinationofceftazidimeandanovelβ-lactamaseinhibitor(avibactam)approvedbytheU.S.FoodandDrugAdministrationandtheStateAdministrationofChinaforthetreatmentofcomplexabdominalandurinarytractinfections,hospital-acquiredbacterialpneumonia,andventilator-associatedbacterialpneumonia,particularlythosecausedbyKlebsiellapneumoniae.However,theclinicaluseofCZAhasledtotheemergenceofmultidrug-resistantKlebsiellapneumoniae.Therearethreemainmechanismsofdrugresistance:mutationofblakpc,mutationofcellmembraneporeprotein,andincreasedexpressionofKPCenzyme.ThearticlereviewstheprevalenceandmechanismofKlebsiellapneumoniaeresistanttoCZA,aimingtoprovidescientificbasisfortheclinicalpreventionandtreatmentofdrug-resistantstrainsofCZAandprovideguidanceforthedevelopmentofnewdrugs.Keywords:KPC-producingKlebsiellapneumoniae;ceftazidime;avibactam;drugresistance;mechanismmec...