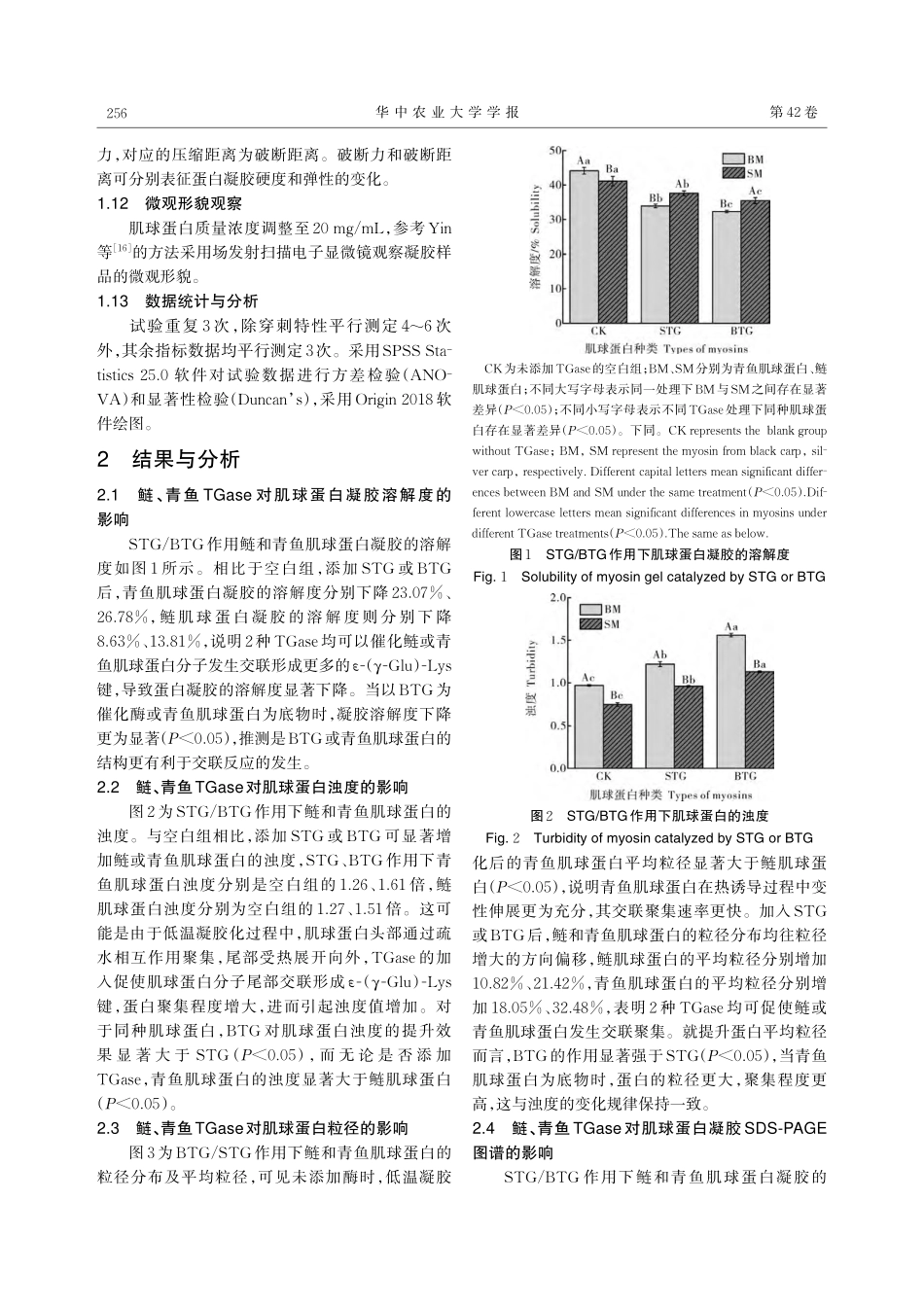
第42卷第4期2023年7月华中农业大学学报JournalofHuazhongAgriculturalUniversityVol.42No.4July2023,254~261鲢和青鱼转谷氨酰胺酶诱导下肌球蛋白凝胶特性的研究易林,安玥琦,张晗玮,熊善柏华中农业大学食品科学技术学院/国家大宗淡水鱼加工技术研发分中心(武汉)/长江经济带大宗水生生物产业绿色发展教育部工程研究中心,武汉430070摘要为探究不同品种淡水鱼转谷氨酰胺酶(transglutaminase,TGase)对肌球蛋白凝胶特性的影响,以鲢和青鱼肌球蛋白为试验对象,分别测定鲢转谷氨酰胺酶(silvercarptransglutaminase,STG)和青鱼转谷氨酰胺酶(blackcarptransglutaminase,BTG)作用下肌球蛋白在低温凝胶化后溶解度、蛋白聚集、流变学特性、穿刺特性和微观形貌的变化。结果显示:与未加酶组相比,添加2种TGase后均可催化鲢或青鱼肌球蛋白交联形成更多的ε-(γ-Glu)-Lys异肽键,导致肌球蛋白重链(myosinheveaychain,MHC)的聚集程度增加,蛋白浊度值及平均粒径显著增大(P<0.05),肌球蛋白凝胶的弹性模量(G')明显增大,凝胶破断力和破断距离显著提升(P<0.05),蛋白网络结构增强。在提升同种肌球蛋白凝胶特性方面,BTG的催化交联作用强于STG;而BTG的比酶活(12.67U/mg)低于STG的比酶活(14.34U/mg),且无论是否添加TGase,青鱼肌球蛋白的凝胶特性始终高于鲢肌球蛋白。综上,不同品种淡水鱼糜凝胶特性的差异并非主要由TGase的活性差异所导致,而与其肌球蛋白的来源密切相关。关键词转谷氨酰胺酶;肌球蛋白;凝胶特性;流变学特性;凝胶网络结构中图分类号TS254.4文献标识码A文章编号1000-2421(2023)04-0254-08我国淡水渔业资源丰富,2021年淡水鱼养殖产量高达2640.28万t,位居世界第一[1]。渔业生产快速增长的同时也带动了淡水鱼糜制品产业的发展,鲢、草鱼、青鱼等低值淡水鱼成为鱼糜及鱼糜制品加工的重要原料。然而,不同品种淡水鱼糜凝胶特性差异显著,肉食性青鱼鱼糜的凝胶形成能力要优于鲢、草鱼等滤食性或草食性鱼类。这与鱼糜凝胶化阶段,内源性转谷氨酰胺酶(TGase)诱导的肌球蛋白交联反应密切相关。Araki等[2]研究发现鲤TGase对不同鱼类肌球蛋白聚合速率的影响差异显著。Binsi等[3]试验发现不同海水鱼TGase作用下,比目鱼肌球蛋白凝胶强度、肌球蛋白重链(MHC)聚集程度与TGase的活性呈正相关。贾丹[4]在对比7种淡水鱼糜的化学组成和凝胶特性的研究中也有类似发现,鱼糜的谷氨酸和赖氨酸含量、TGase活性与鱼糜凝胶...