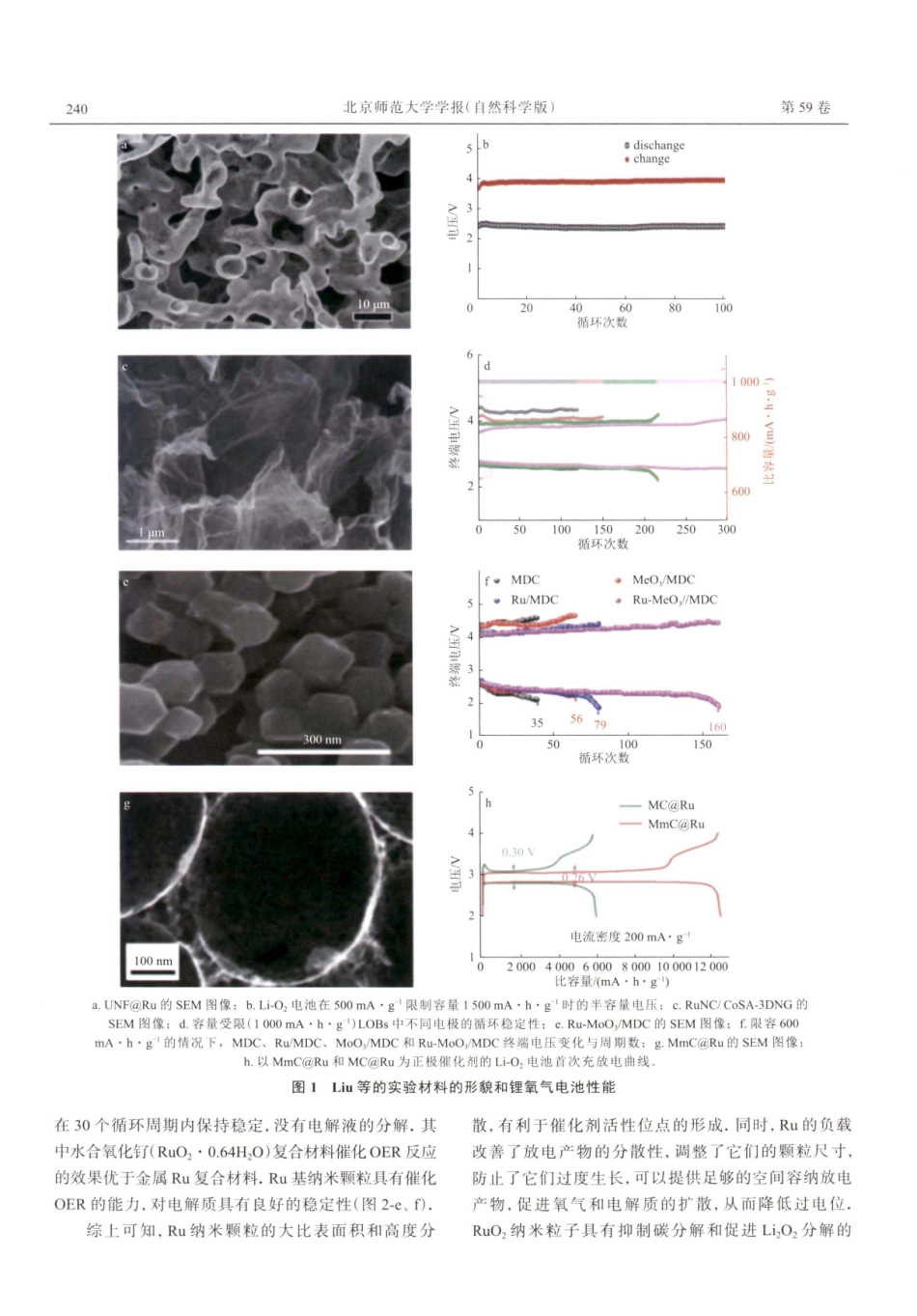
23859(2)JournalofBeijingNormalUnive(NaturalScience)2023-04北京师范大自然科学版)可充电锂氧气电池正极材料的研究进展一贵金属催化剂林雨冉张书婷邱嘉晨南彩云(北京师范大学化学学院,100875,北京)摘要锂氧气电池具有较高的理论能量密度,有望成为未来一种很有前途的新型电池系统。贵金属催化剂不仅具有较高的催化活性,而且具有耐高温、抗氧化、耐腐蚀等综合优良性能,是一种重要的催化剂材料。本文综述了贵金属基锂氧气电池正极材料的制备方法及其对电池性能的影响,包括钉、、钯、银、铱、铂、金以及复合贵金属催化剂.关键词锂氧气;贵金属;正极材料;电池中图分类号号0611.3D0I:10.12202/j.0476-0301.20222310引言可充电锂氧气电池于1991年提出至今已有30多年的时间,还有很多问题需要不断探索和解决。锂氧气电池是金属锂电池,负极是锂,正极是活性氧。锂氧气电池正极的充放电反应动力学缓慢,有着比容量低、循环性能差、能量效率偏低等问题[2-4]。锂氧气电池主要发生氧还原和氧析出反应.氧还原反应(oxygenreductionreaction,ORR)是在放电过程中,金属锂失去电子变为锂离子,电子由外电路转移至空气正极,锂离子经电解液到达正极与扩散进来的O2反应,在催化剂作用下生成LizO2,其中O2发生还原反应.氧析出反应(oxygenevolutionreaction,OER)是充电过程中,LizO2分解生成O,和Lit,Lit由电解液转移回负极,电子经外电路回到负极并再次与Li结合生成锂,充电过程中有O,析出[5]。电池反应方程式为正极:2(Lit+e)+O2→Li,O2,(1)负极:Li→Lit+e',(2)总反应:2Li+O2→LizO2.(3)与锂氧气电池相同,燃料电池主要由4部分,即阳极、阴极、电解质和外部电路组成.反应原理是将燃料气和氧化气分别由燃料电池的阳极和阴极通人,燃料气在阳极上放出电子,电子经外电路传导到阴极并与氧化气结合生成离子。离子在电场作用下,通过电解质迁移到阳极上,与燃料气反应,构成回路,产生电流.目前燃料电池中常用的商用催化剂是铂(Pt)催化剂,Pt具有良好的分子吸附、离解特性,因此Pt催化剂成为最理想、也是当前唯一商业化的催化剂材料。锂氧气电池的正极反应需要催化剂,放电过程如果没有催化剂的作用,O,还原会非常缓慢.因此,在正极负载催化剂,可以很好地提高动力学性能,解决充放电过电势低、提高电池容量、改善循环性能等问题[6-8].贵金属催化剂作为锂氧气电池的正极催化剂材料,对电池性能的改善有着很好的效果,在电催化领域中有着重要的应用[9-1...