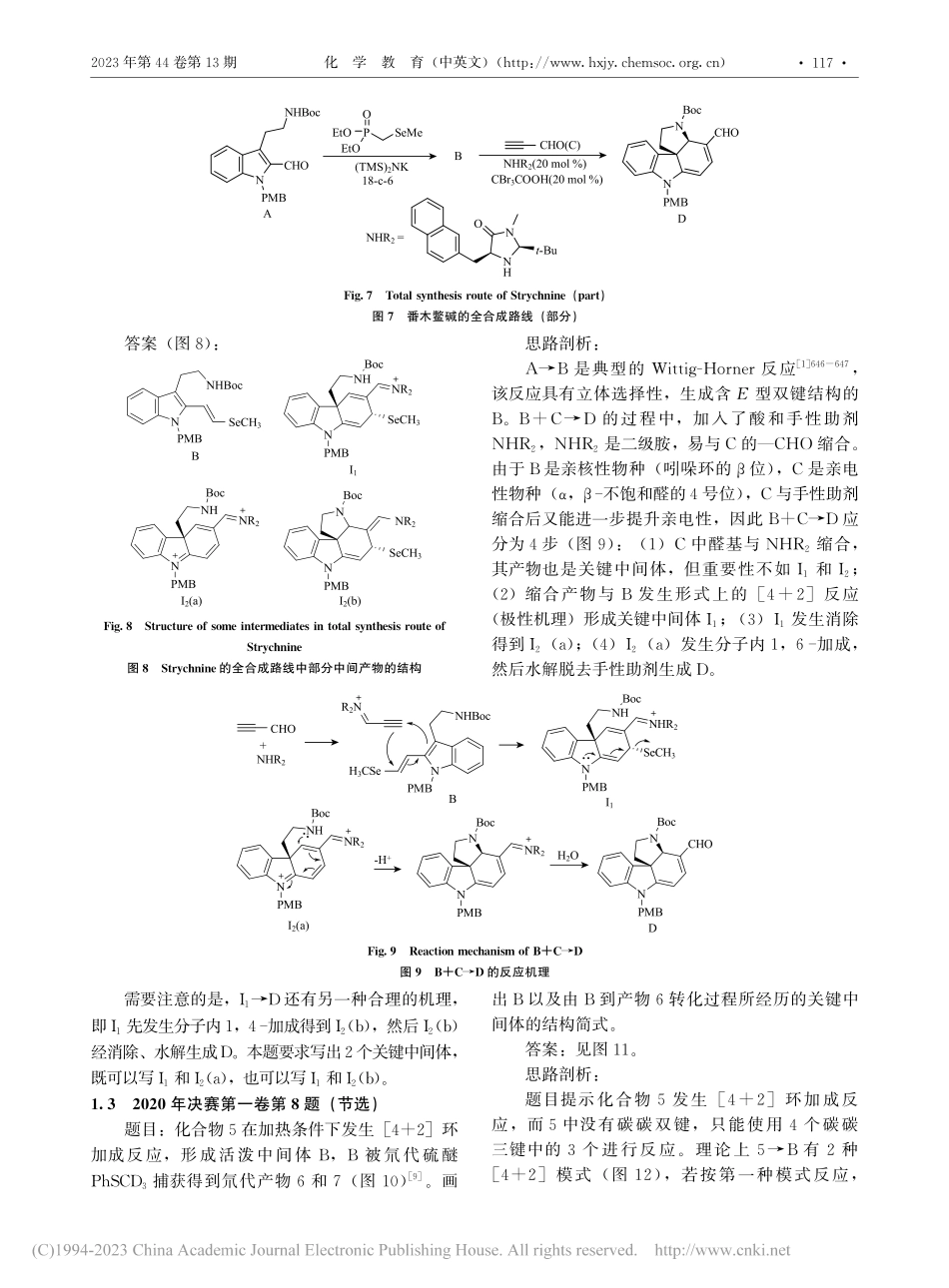
*中国化学会化学教育委员会“十四五”规划2021年重点课题“新教育理念下化学课程资源开发与实践研究”(HJ2021-0039)**通信联系人,E-mail:834989532@qq.com化学奥林匹克竞赛中的周环反应*黄昕晨1**卓峻峭2莫尊理3(1.深圳中学广东深圳518024;2.重庆市南开中学校重庆400030;3.西北师范大学化学化工学院甘肃兰州730070)摘要将2016—2021年高中化学竞赛中与周环反应相关的试题分为环加成反应、电环化反应、σ迁移反应和ene反应等4类,分析了试题并给出了解题思路,总结了化学竞赛对周环反应的考查趋势,并对今后化学竞赛中周环反应的教学提出相关建议。关键词化学奥林匹克竞赛周环反应环加成反应DOI:10.13884/j.1003-3807hxjy.2022080045周环反应指经历环状过渡态的协同反应(协同反应:一步完成多个化学键的生成与断裂,没有经历自由基、离子等活性中间体),反应条件一般为加热或光照,可以通过改变反应条件实现立体选择性。周环反应是构建分子骨架的重要手段,在全合成中有着不可替代的地位,是有机化学学习的重点[1]409-445。从2016年开始,化学竞赛中有机化学试题的难度迅速提升[2-4],每年的试题都涉及周环反应相关的知识点。因此,研究近年化学竞赛中周环反应相关试题,深入分析解题思路,总结周环反应特点,增进师生对周环反应的认识和理解,对化学竞赛的教学显得非常迫切和必要。本文按照环加成反应、电环化反应、σ迁移反应和ene反应等4个类别系统地讨论了2016-2021年高中化学竞赛中涉及周环反应的试题。1环加成反应环加成反应中最常考查的是[4+2]型(Diels-Alder反应)及其逆反应,其次是[3+2]型(1,3偶极环加成)和[2+2]型。基础有机化学教材中关于环加成反应的知识点主要包括:(1)Diels-Alder反应中构象和取代基电子效应的影响;(2)Diels-Alder反应的区域选择性;(3)Diels-Alder反应的立体选择性(内型产物或外型产物);(4)用前线轨道理论、芳香过渡态理论或能量相关理论解释环加成反应的立体选择规则(同面同面加成或同面异面加成)[1]409-445。化学竞赛试题主要以合成中各类环加成反应的应用实例为素材,考查知识点(1)、(3),而对知识点(2)、(4)的考查较少。环加成反应可以灵活地构建各种环状结构,甚至能够利用串联反应一次性构建多个环,因此环加成反应在药物、天然产物的合成中应用十分广泛。1.12021年决赛第一卷第8题(节选)题目:在天然产物amathaspiramideA的全合成中利用了Me3SiCHN2参与的偶极环加成反应[5-6],画出图1所示全合成路线中化合物C、D和F的结构简式(不考虑...