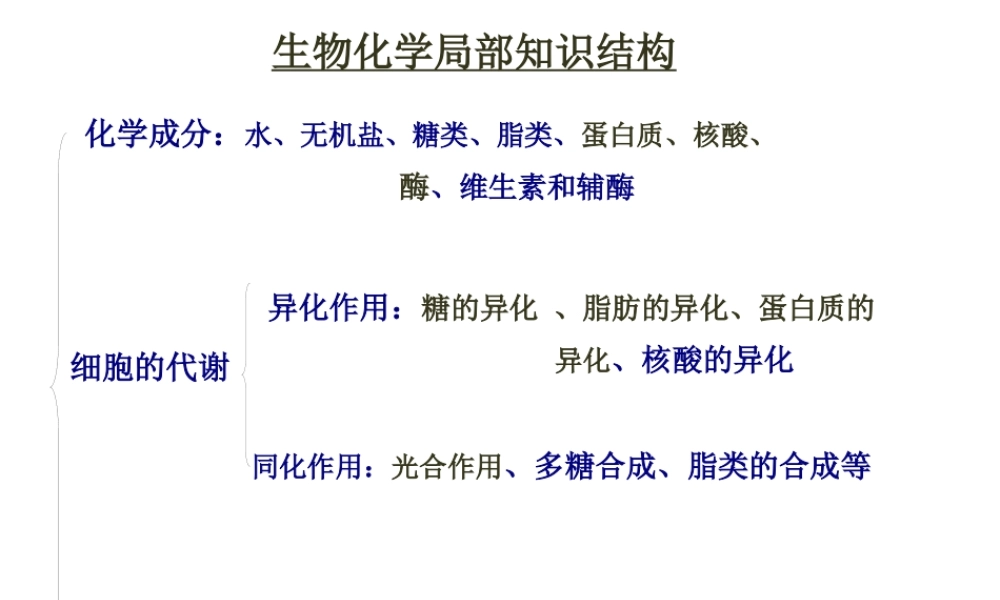
生物化学局部知识结构化学成分:水、无机盐、糖类、脂类、蛋白质、核酸、酶、维生素和辅酶细胞的代谢异化作用:糖的异化、脂肪的异化、蛋白质的异化、核酸的异化同化作用:光合作用、多糖合成、脂类的合成等分子生物学:复制、转录、翻译、调控第一页,共三十二页。蛋白质的结构与功能第一章第二页,共三十二页。一、什么是蛋白质?蛋白质(protein)是由许多氨基酸(aminoacids)通过肽键(peptidebond)相连形成的高分子含氮化合物。组成蛋白质的元素主要有C、H、O、N和S。有些蛋白质含有少量磷或金属元素铁、铜、锌、锰、钴、钼,个别蛋白质还含有碘。第三页,共三十二页。1、蛋白质的元素组成:氮的含量在多种的蛋白质比较接近,平均为16%,因此用凯氏〔kjelahl〕法定N,受检物质中含蛋白质量为N含量的6.25倍。★蛋白质含量的测定:凯氏定氮法(测定氮的经典方法)优点:对原料无选择性,仪器简单,方法也简单;缺点:易将无机氮,都归入蛋白质中,不精确。样品含氮量平均在16%,取其倒数100/16=6.25,即为蛋白质换算系数,其含义是样品中每存在1g元素氮,就说明含有6.25g蛋白质〕;故:※蛋白质含量=氮的量×100/16第四页,共三十二页。一、氨基酸——组成蛋白质的根本单位存在自然界中的氨基酸有300余种,但组成人体蛋白质的氨基酸仅有20种.必需氨基酸和非必需氨基酸:必需氨基酸包括亮氨酸、异亮氨酸、缬氨酸、苏氨酸、蛋氨酸〔甲硫氨酸〕、色氨酸、赖氨酸、苯丙氨酸等8种。精氨酸和组氨酸为半必需氨基酸。第五页,共三十二页。2、蛋白质的氨基酸组成〔1〕氨基酸的结构天然蛋白质中存在的氨基酸都是L-a-氨基酸COOH|NH2—C—H|RL-a-氨基酸一种为脯氨酸,它也有类似结构,但侧链与氮原子相接形成亚氨基酸。除甘氨酸外,蛋白质中的氨基酸都具有不对称碳原子,都有L—型与D一型之分,为区别两种构型,通过与甘油醛的构型相比较,人为地规定一种为L型,另种为D一型。当书写时—NH2写在左边为L型,-NH2在右为D一型。能看出天然蛋白质中的氨基酸都属L型。第六页,共三十二页。1.非极性疏水性氨基酸〔7〕甘丙缬亮异苯脯2.极性中性氨基酸〔8〕色丝酪半蛋天谷苏3.酸性氨基酸〔2〕天谷4.碱性氨基酸〔3〕赖精组〔一〕氨基酸的分类第七页,共三十二页。〔二〕氨基酸的理化性质1.两性解离及等电点氨基酸是两性电解质,其解离程度取决于所处溶液的酸碱度。等电点(isoelectricpoint,pI)在某一pH的溶液中,氨基酸解离成阳离子和阴离子的趋势及程度相等,成为兼性离子,...