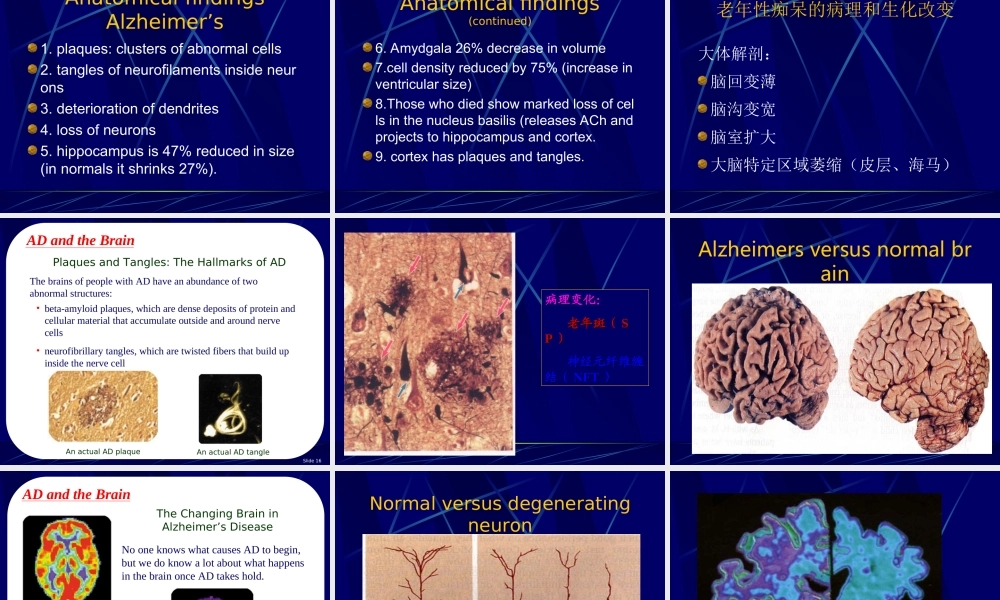
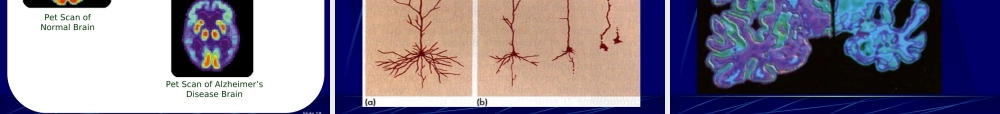
ALZHEIMER’SDISEASE历史回顾1906年,德国神经病理学家阿洛依斯·阿尔兹海默在检查一位55岁女性死亡病人的大脑切片时发现有异常“沉淀物”沉积在脑组织。对于这一新发现的,不知原因的病例,医学界命名为——阿尔兹海默综合症。痴呆的定义痴呆是一种获得性、持续性智能损害综合症,具有以下至少三项精神活动受损:语言、记忆、视空间能力、情感、人格和其他认知功能(如计算力、抽象判断力)。痴呆的分型痴呆皮质性—阿尔茨海默病、特征匹克病皮质下特征多发性缺血——多梗塞性痴呆发作特征无明显缺血发作运动—锥体外系——障碍综合征痴呆无运动障碍(见下页)慢性进行性舞蹈病、帕金森病、肝豆状核变性、进行性核上性麻痹、脊髓小脑变性痴呆的分型(续前)无运动障碍明显情感障碍——抑郁性痴呆综合征无明显情感障碍脑积水——脑积水痴呆无脑慢性意识积水错乱状态代谢性痴呆、中毒性痴呆、外伤、新生物、脱髓鞘疾病、其他老年性痴呆(AD)概述Alzheimer’sDisease(AD)亦称老年性痴呆(SenileDementia),是一种进行性退行性神经疾病,以大脑皮层颞叶和额页萎缩为著的神经系统退行性病变,临床表现为缓慢进展的认知功能全面衰退,伴有精神异常和人格障碍,病程可长达数年至数十年。世界范围内有二千万阿尔兹海默症患者,绝大多数发生在65岁~90岁以上的老人。统计显示目前中国约有该病患者500万人之多。统计显示,在杭州共有3万多老年痴呆症患者。美国前总统里根,1994年确诊为阿尔兹海默症。DM的流行病学调查在年龄>65岁的人群中痴呆的检出率平均为5%,超出80岁者有严重痴呆者高达15%-20%其中:老年性痴呆占50%-60%,血管性痴呆占10%-20%在亚洲,VD的发生率较高,主要与中风高发率有关国际研究表明,随着年龄的增长,VD的年龄呈指数增长我国不是痴呆的低危地区发病率和国外接近总体:北方〉南方农村〉城市受教育程度低的地区〉相对高的地区流行病学特征无论是北方还是南方,无论是城市还是农村:AD>VaD因此,我国痴呆的主要亚型是AD,而非VaD流行病学特征老年性痴呆的患病率随年龄而增高05101520253035404550患病率(%)65-6970-7475-7980-8485-8990-9495-99年龄(岁)老年性痴呆的易患因素遗传因素环境因素营养不均衡头外伤Down综合征家族史吸烟、过量饮酒低教育程度?AnatomicalfindingsAlzheimer’s1.plaques:clustersofabnormalcells2.tanglesofneurofilamentsinsideneurons3.deteriorationofden...