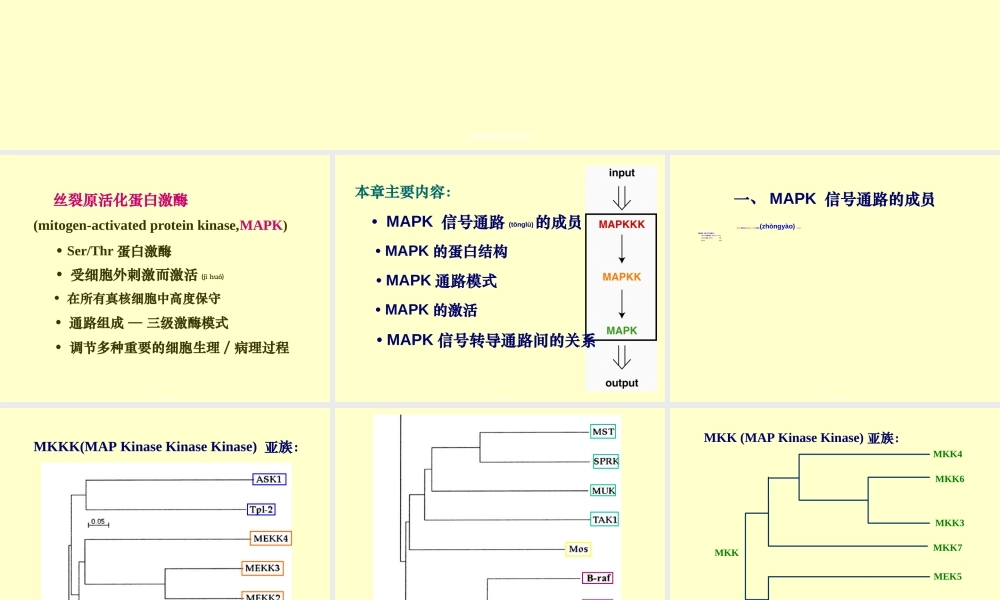
第九章丝裂原活化(huóhuà)蛋白激酶信号转导通路第第第第第第第第第第第第丝裂原活化蛋白激酶(mitogen-activatedproteinkinase,MAPK)•Ser/Thr蛋白激酶•受细胞外刺激而激活(jīhuó)•在所有真核细胞中高度保守•通路组成—三级激酶模式•调节多种重要的细胞生理/病理过程第第第第第第第第第第第第本章主要内容:•MAPK信号通路(tōnglù)的成员•MAPK的蛋白结构•MAPK通路模式•MAPK的激活•MAPK信号转导通路间的关系第第第第第第第第第第第第一、MAPK信号通路的成员MAPK是信号从细胞表面→核内的重要(zhòngyào)转递者。已鉴定的(据1999的统计):MAPK激酶激酶(MKKK)14种MAPK激酶(MKK)7种MAPK12种第第第第第第第第第第第第MKKK(MAPKinaseKinaseKinase)亚族:第第第第第第第第第第第第第第第第第第第第第第第第MKK(MAPKinaseKinase)亚族:MEK5MEK2MEK1MKK7MKK4MKK6MKK3MKK第第第第第第第第第第第第MAPK(MAPKinase)亚族:ERK2ERK1ERK4ERK3ERK5JNK2JNK3JNK1第第第第第第第第第第第第JNK2JNK3JNK1p38βp38αp38δp38γ第第第第第第第第第第第第二、MAPK的蛋白结构(jiégòu)(一)MAPK的一级结构苏氨酸磷酸化位点与其他蛋白激酶同源,酪氨酸磷酸化位点是MAPK独特的。磷酸化位点的三肽模体—TXYERK和ERK5—TEYp38—TGYJNK—TPY第第第第第第第第第第第第第第第第第第第第第第第第第•三肽模体位于(wèiyú)L12•各亚族L12长度不同•活化唇(activationlip)•各亚族都具有12个保守亚区—真核细胞蛋白激酶超家族区分标志之一•家族成员之间具有较高的同源性第第第第第第第第第第第第第MAPK其他名称与ERK2的同源性%同一亚族成员序列相似性%ERK1p44MAPK88ERK2p42MAPK100ERK3αp62ratERK343100ERK3βhumanERK34274JNK1SAPKγ4087JNK2SAPKα41100JNK3SAPKβ4088哺乳动物(bǔrǔdòngwù)MAPK第第第第第第第第第第第第第哺乳动物(bǔrǔdòngwù)MAPKMAPK其他名称与ERK2的同源性%同一亚族成员序列相似性%ERK2p42MAPK100p38αp38CSBP50100p38βp38-24775p38γERK6SAPK34462p38δSAPK44264ERK5BMK151ERK741第第第第第第第第第第第第第第第第第第第第第第第第第第(二)MAPK的二级结构和超二级结构以ERK2为例N端域—主要(zhǔyào)由β折叠和2个α螺旋组成(1~109和320~358位氨基酸残基)C端域—α螺旋,含磷酸化唇和MAPK插入,催化环(Arg-147~152)(110~319位氨基酸残基)交界处的裂隙—ATP结合位点第第第第第第第第第第第第第第第第第第第第第第第第第第第第...