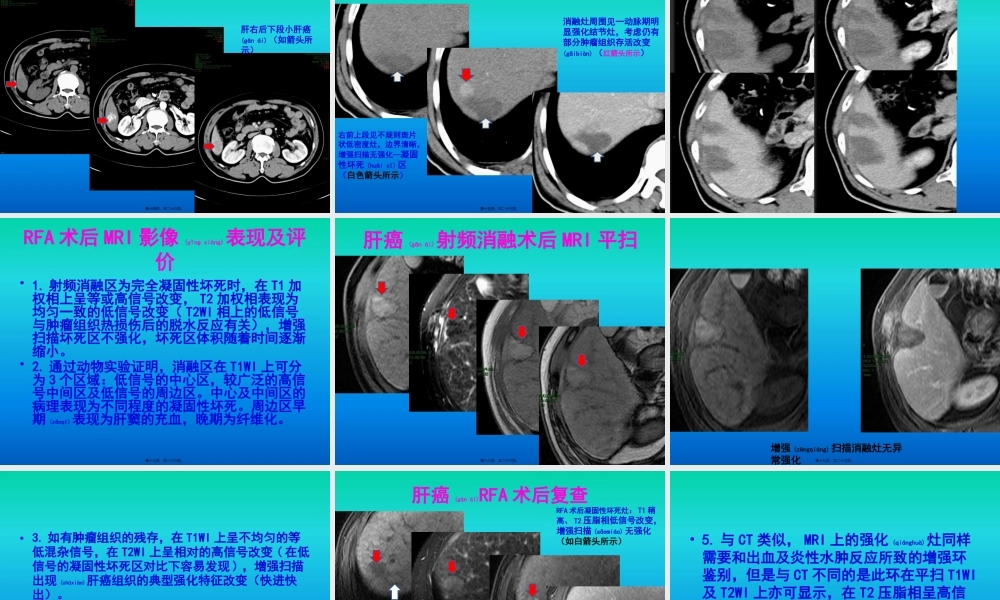
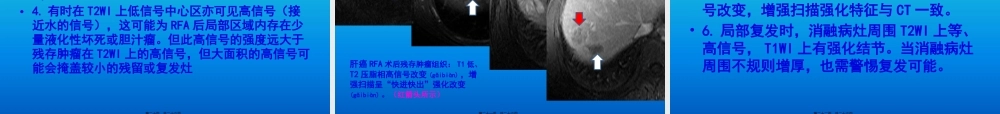
浅谈肝癌射频消融术后影像(yǐnɡxiànɡ)评价作者:江华堂工作单位:广东医学院附属(fùshǔ)医院放射科第一页,共二十六页。•肝癌射频消融治疗(RFA)是借助影像手段导向,通过热效应引起肝癌组织凝固性坏死的一种治疗方法。•北美放射学会于1997年提出肿瘤消融的概念(gàiniàn),将其分为化学消融、热消融、冷冻消融。RFA属于热消融。第二页,共二十六页。RFA治疗(zhìliáo)机制•1.高温使靶区的肿瘤组织发生凝固性坏死(huàisǐ),直接杀灭肿瘤细胞。•2.高温影响肿瘤细胞质膜的相变及流动性,从而影响细胞膜的各种功能。•3.高温增加肿瘤细胞内溶酶体酶的活性,影响多种细胞器尤其是线粒体的正常功能。•4.高温使肿瘤周围的血管组织凝固,形成反应带,从而减少或阻断肿瘤血供,防止肿瘤扩散。第三页,共二十六页。•5.在肿瘤(zhǒngliú)细胞发生凝固性坏死过程中,细胞膜等部位抗原暴露或肿瘤(zhǒngliú)细胞免疫表型变化,可刺激机体产生特异性抗体,而杀灭或抑制肿瘤(zhǒngliú)的生长或扩散,即所谓的“内源性疫苗”作用。第四页,共二十六页。RFA后肝组织(zǔzhī)病理演变•1.术后24h-48h:表现为三个不同(bùtónɡ)的区域:(1)中央坏死区表现为肝细胞的分离和组织的坏死。(2)由于中央坏死堵塞了流出道,移行区表现为肝窦内充血。(3)周围区域表现出轻微的反应,主要为肝细胞水肿及肝窦充血。第五页,共二十六页。•3-10d:中央区肿瘤(zhǒngliú)细胞凝固性坏死,移行区及周围区域局部粒细胞浸润,肝窦充血膨胀,并可见肝细胞再生及肉芽组织的生成。•10d-6个月,再生组织逐渐过渡为瘢痕组织。•6个月后,中央坏死区四周为瘢痕组织,瘢痕组织四周又被正常肝组织包绕。第六页,共二十六页。RFA术后影像(yǐnɡxiànɡ)评价手段•超声(US)•X线计算机体层成像(CT)•磁共振成像(MRI)•数字减影血管(xuèguǎn)造影(DSA)•核医学影像第七页,共二十六页。RFA术后CT影像表现(biǎoxiàn)及评价•肝癌(ɡānái)RFA后CT扫描显示消融区低密度,多呈圆形或卵圆形,也可表现为不规则形(视消融电极形态而定),并随着时间逐渐缩小甚至完全消失。日本肝癌研究协会2009年修订的肝癌治疗后疗效评价指南提出病灶完全坏死的标准:原病灶于增强CT的动脉期和延迟期呈无残存低密度表现,较周围肝实质表现为更低密度区域,并且无残存低密度区需要覆盖术前CECT延迟期扫描显示的低密度区,否则局部复发率较高。•部分病例表现在低密度消...