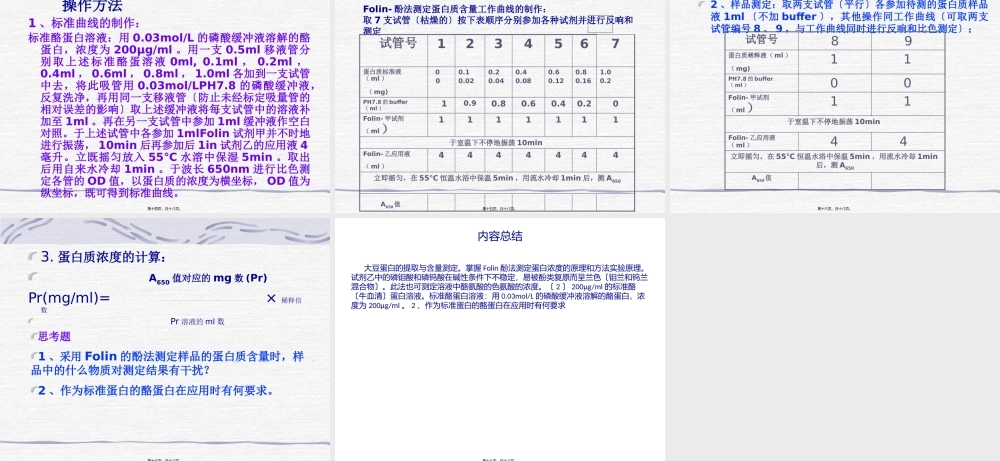
大豆蛋白的提取与含量测定第一页,共十八页。蛋白质化学实验蛋白质是一切生物体内重要的组成成份,蛋白质是由二十多种氨基酸以肽键相互联接而成的复杂的高分子化合物,溶于水时形成亲水胶体溶液。在酸碱和酶的作用下,蛋白质被水解成胶胨肽最后形成氨基酸。蛋白质分子依靠氢键、盐键等副价键维持一定的空间构型。在各种物理化学因素影响下,由于副价键的破裂,使其空间结构遭受不同程度的破坏,蛋白质的物理化学性质和生物学活性也随着改变。该现象称为蛋白质的变性。第二页,共十八页。蛋白质分子是含有酸性基团和碱性基团的两性电解质,在等电点时,蛋白质分子的酸性基团和碱性基团的解离度相等,成为带有正负电荷相等的两性离子,在电场中不向两极移动,并且极易沉淀。氨基酸组成不同的蛋白质,具有不同的等电点。根据在一定条件下〔如PH,离子强度等〕它们所带电荷的数量和种类,分子的大小及形状等方面的差异,可以采用电泳,离子交换柱层析等方法对它们进行别离分析。许多物理化学因素可以改变蛋白质在水中的溶解度,产生可逆或不可逆沉淀,这些因素〔如增加溶液的离子强度,降低溶液的介电常数,调节溶液的PH等〕以及一些沉淀剂和胶附剂也常用来别离,提纯蛋白质或除去蛋白质。为了更好地使同学们运用和掌握好理论和实践相结合,把学到的理论应用到实验中,本系列实验安排是从一种生物中提取蛋白质,通过各种物理化学性质使其得到纯化,得到蛋白质,并进行浓度测定,计算其收率。第三页,共十八页。蛋白质性质与应用技术关系图蛋白质酸碱酶极性电荷离子交换层析电泳形状分子量离心凝胶层析肽氨基酸疏水性亲水性低层析第四页,共十八页。一、大豆蛋白的提取目的要求1、掌握大豆蛋白的提取原理和方法2、计算粗提产率2、学习计算蛋白质收率实验原理大豆中含有丰富的蛋白质、根据其性质不同,可以分为水溶蛋白、盐溶蛋白、醇溶蛋白、碱溶蛋白。将豆粉依次用上述溶剂提取,并用有机溶剂沉淀,可制得各局部蛋白质的干粉。本实验主要是水溶提取大豆蛋白。称出提出蛋白质的重量,能看出原料重量,可以求出蛋白质的收率。第五页,共十八页。试剂和器材1、试剂〔1〕10%Nacl〔2〕0.2%NaoH〔3〕75%乙醇〔4〕6mol/LHCL〔5〕1mol/LHCL〔6〕1mol/LNaoH2、器材〔1〕离心机〔2〕烧杯〔3〕滴管〔4〕PH试纸等第六页,共十八页。操作方法1、水抽提将豆粉5g用约40毫升左右的蒸馏水少量屡次的添加搅拌,常温下搅拌抽提15min,3800r/min离心15min,取上清液,如上清...