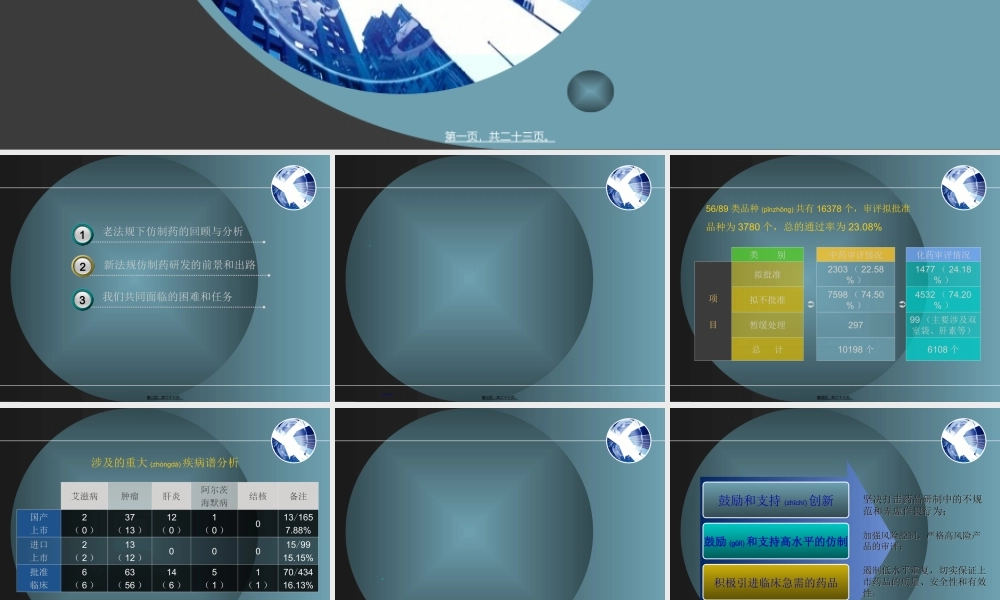
仿制药的研发(yánfā)和评价第一页,共二十三页。新法规仿制药研发的前景和出路2老法规下仿制药的回顾与分析31我们共同面临的困难和任务3第二页,共二十三页。2008年药品审评情况第三页,共二十三页。类别中药审评情况化药审评情况项目拟批准2303(22.58%)1477(24.18%)拟不批准7598(74.50%)4532(74.20%)暂缓处理29799(主要涉及双室袋、肝素等)总计10198个6108个56/89类品种(pǐnzhǒng)共有16378个,审评拟批准品种为3780个,总的通过率为23.08%第四页,共二十三页。艾滋病肿瘤肝炎阿尔茨海默病结核备注国产上市2(0)37(13)12(0)1(0)013/1657.88%进口上市2(2)13(12)00015/9915.15%批准临床6(6)63(56)14(6)5(1)1(1)70/43416.13%涉及的重大(zhòngdà)疾病谱分析备注(bèizhù):()内为国内尚未上市的新药第五页,共二十三页。(pīzhǔn)第六页,共二十三页。鼓励和支持(zhīchí)创新鼓励(gǔlì)和支持高水平的仿制积极引进临床急需的药品坚决打击药品研制中的不规坚决打击药品研制中的不规范和弄虚作假行为;范和弄虚作假行为;加强风险控制,严格高风险产加强风险控制,严格高风险产品的审评;品的审评;遏制低水平重复,切实保证上遏制低水平重复,切实保证上市药品的质量、安全性和有效市药品的质量、安全性和有效性。性。第七页,共二十三页。第八页,共二十三页。(pīzhǔn)第九页,共二十三页。第十页,共二十三页。第十一页,共二十三页。第十二页,共二十三页。(zhòngdiǎn)第十三页,共二十三页。第十四页,共二十三页。第十五页,共二十三页。前景(qiánjǐng)出路新法规(fǎguī)要义严格实施管理办法公众需求研发方向现实国情下研发的核心问题从技术、管理等方面加强应对策略对审评工作的现实要求第十六页,共二十三页。新药要“新新药要“新””仿制要“同仿制要“同””改剂型改剂型(jìxíng)(jìxíng)要要“优”“优”研究要“实研究要“实””实优同新仿制药的研究目标就是要达到和已上市(shàngshì)产品的质量一致、临床可替代。第十七页,共二十三页。由有药可用,到用由有药可用,到用""好”药,再到用高质量的“好”药好”药,再到用高质量的“好”药开发(kāifā)药,到开发(kāifā)“好”药,再到开发(kāifā)高质量的“好”药公众(gōngzhòng)需求研发方向高质量药品“好”------选”好”品种高质量------科学研发,保证质量第十八页,共二十三页。第十九页...