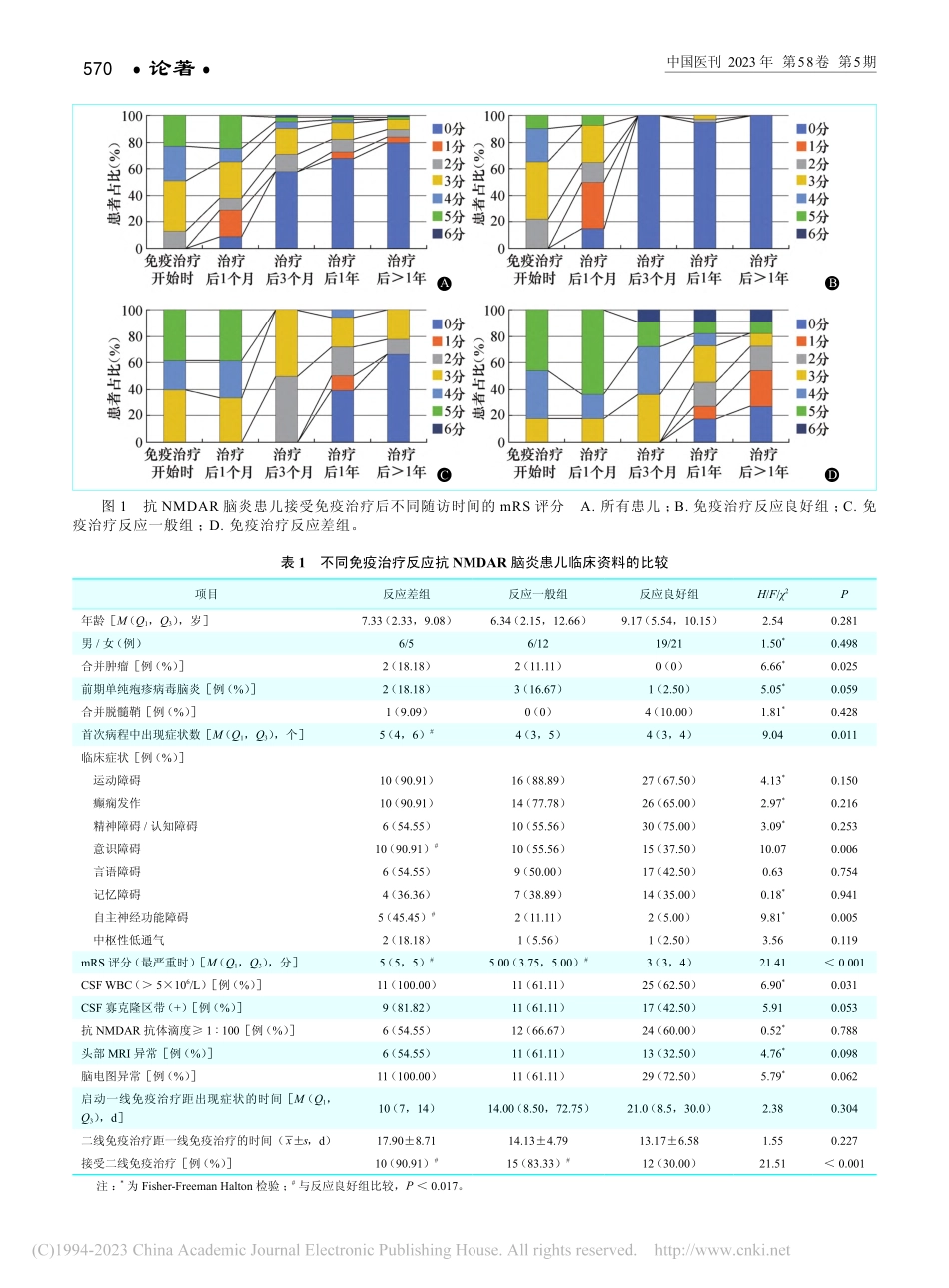
568·论著·中国医刊2023年第58卷第5期抗N-甲基-D-天冬氨酸受体(N-methyl-D-aspartatereceptor,NMDAR)脑炎是一种由抗体介导的具有复杂的神经精神症状的自身免疫性疾病,其特征是存在针对NMDARGluN1亚单位的脑脊液(cerebrospinalfluid,CSF)抗体,其每年的发病率约为1.5/100万[1]。自2007年被报道以来,在探索抗NMDAR脑炎的发病机制和有效治疗策略方面取得了显著进展[2]。免疫治疗通常是抗NMDAR脑炎首选的治疗方案,目前已被证实能改善患者的预后并减少复发,最常用的包括糖皮质激素、静脉注射免疫球蛋白、血浆置换以及一线治疗效果不佳者应用利妥昔单抗(rituximab,RTX)、环磷酰胺(cyclophosphamide,CYC)、吗替麦考酚酯(mycophenolatemofetil,MMF)等治疗,但仍有19.4%~25.5%的患者对常规免疫治疗不敏感,且部分患者会遗留长期的神经功能缺陷[3-4]。了解疾病的演变过程和治疗后的恢复情况是该病面临的最大挑战之一。既往的研究多是以1年预后作为结局指标分析影响疾病转归的预测因素[4-5]。2021年美国神经病学分会制订的儿童抗NMDAR脑炎治疗的国际共识中首次对免疫治疗反应的评估进行了定义[6],其有助于早期预测患者的康复轨迹,并识别可能受益于新型免疫治疗方案的患者,指导临床医生的治疗决策,然而目前预测免疫治疗反应的临床、亚临床因素尚未见报道。故本研究对本院神经内科诊断的抗NMDAR脑炎患儿的免疫治疗反应进行评估,从临床特征及辅助检查等多方面综合探讨影响免疫治疗反应的危险因素,为评估抗NMDAR脑炎的临床进程及优化治疗方案提供依据。1资料与方法1.1纳入对象回顾性分析2014年2月至2021年11月本院神经内科收治的抗NMDAR脑炎患儿,纳入标准:①诊断符合中华医学会神经病学分会制订的抗NMDAR脑炎的诊断标准[7];②接受正规免疫治疗;③起病至末次随访时间>1年(或患儿因抗NMDAR脑炎死亡)。排除标准:①起病年龄大于18岁;②诊断不明确或随访过程中更改为其他诊断的病例。本研究通过本院医学伦理委员会审批(审批号:SHERLL2020012)。儿童抗N-甲基-D-天冬氨酸受体脑炎的免疫治疗疗效及危险因素研究郑萍,孙静,冯硕,张建昭,李冠男,马才惠,陈倩*(首都儿科研究所附属儿童医院神经内科,北京100020)摘要:目的分析儿童抗N-甲基-D-天冬氨酸受体(N-methyl-D-aspartatereceptor,NMDAR)脑炎的免疫治疗疗效及免疫治疗反应差的危险因素。方法回顾性分析2014年2月至2021年11月在首都儿科研究所附属儿童医院神经内科住院...