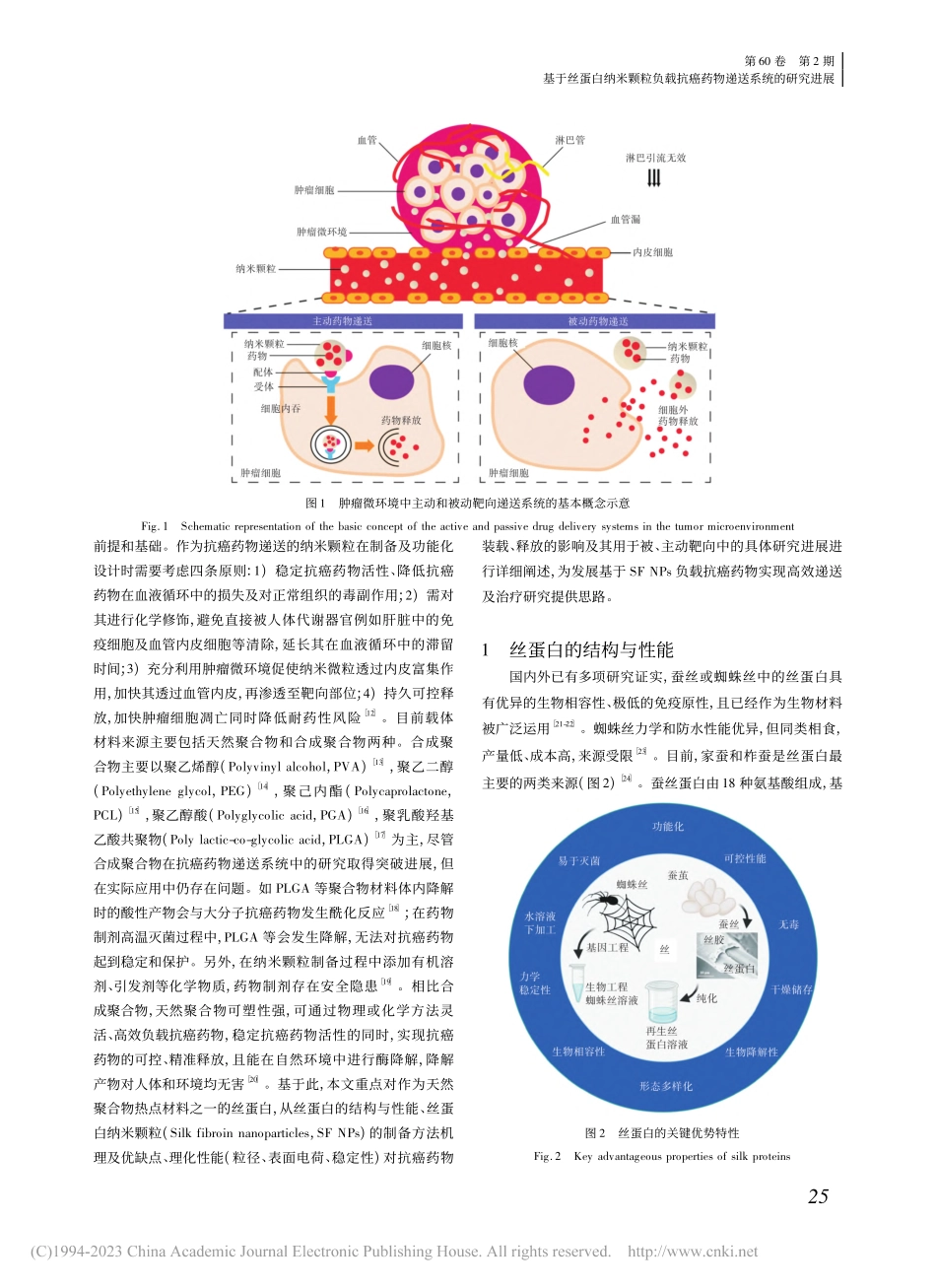
研究与技术丝绸JOURNALOFSILK基于丝蛋白纳米颗粒负载抗癌药物递送系统的研究进展Researchdevelopmentoftheanti-cancerdrugdeliverysystembasedonsilkfibroinnanoparticles吴建兵1,李靖雯1,周欣楠1,孙银银1,王永峰2(1.常熟理工学院纺织服装与设计学院,江苏苏州215500;2.中国科学院苏州纳米技术与纳米仿生所国际实验室,江苏苏州215123)摘要:针对抗癌药物存在血液循环清除快、易脱靶、生物利用度低等问题,本文对抗癌药物递送系统中丝蛋白纳米颗粒的材料选择,方法原理分类及优缺点、理化性能对抗癌药物递送的影响及其在被主动靶向递送中的具体研究进展进行全面综述,并重点比较了丝蛋白纳米颗粒的制备方法及其理化性能对抗癌药物负载和递送的影响。综合分析表明,丝蛋白纳米颗粒的研究应着重从方法创新、提升其理化性能及精准靶向与延长疗效等多方面协同入手,充分发挥其在抗癌药物递送系统中的各种优势,为促进癌症病人的高效治疗提供更多选择机会。关键词:抗癌药物;纳米颗粒;丝蛋白;递送系统;被动靶向;主动靶向中图分类号:TS101.4文献标志码:A文章编号:10017003(2023)02002411引用页码:021103DOI:10.3969/j.issn.1001-7003.2023.02.003收稿日期:20220414;修回日期:20221211基金项目:国家自然科学青年基金项目(51903019);江苏省高等学校自然科学面上基金项目(17KJB540001,19KJB430006);常熟理工学院大学生创新创业计划项目(XJDC2020110)作者简介:吴建兵(1990),男,讲师,主要从事丝蛋白生物医用材料的研究。癌症已严重威胁人类生命健康,随着全球老年化进程加快,癌症发病率和致死率都在迅速上升,给家庭和社会带来沉重负担[1]。手术切除和放射疗法是目前最直接、最有效的治疗手段,但仅适用于局部和非转移性肿瘤。早期癌症具有隐匿性,当病人出现不适症状时已发展到中晚期,只能依靠化学疗法控制[2]。抗癌化疗药物在人体分布具有随机性,癌细胞被杀伤的同时也会损伤正常细胞。除此之外,抗癌药物存在血液循环清除快、易脱靶,生物利用度低等问题[3]。因此化学疗法的弊端逐渐显现,包括给药次数多,周期长,且对器官毒副作用大,易诱发神经病变、自身免疫系统及泌尿生殖系统功能障碍。从而导致其疗效不佳,病人顺应性差[4]。如何针对中晚期癌症病人,灵活选择对患者顺应性高、抗毒副作用低、生物利用度高、耐受性好的治疗方法是目前医学界亟须解决的关键问题。利用肿瘤组织与正常组织环境的差异,包括血管密度、渗透性及...