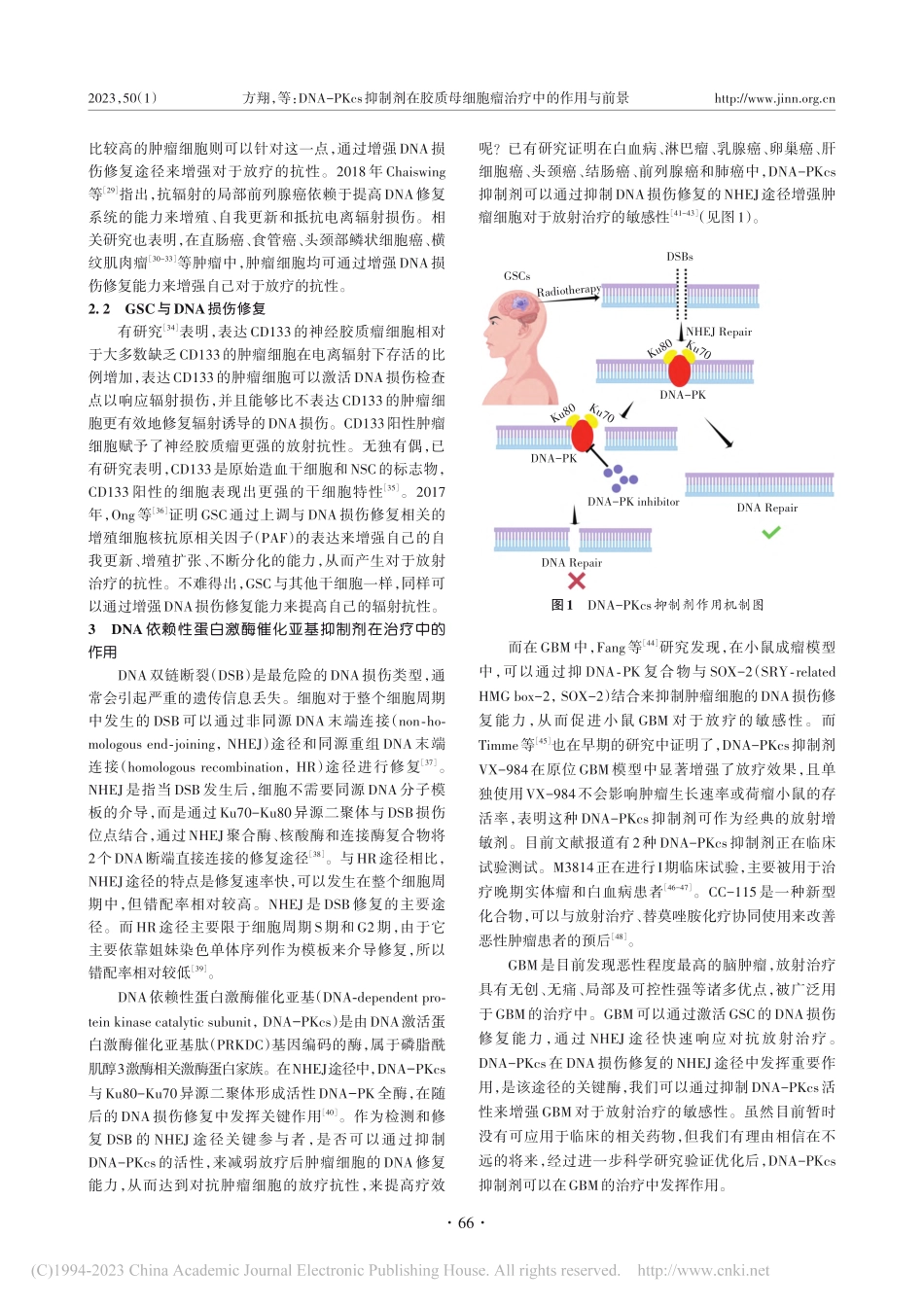
2023年2月Vol.50No.1第50卷第1期Feb.2023国际神经病学神经外科学杂志JournalofInternationalNeurologyandNeurosurgeryDNA-PKcs抑制剂在胶质母细胞瘤治疗中的作用与前景方翔1,田国鹏1,白升伟1,罗玉松1,潘亚文1,2,31.兰州大学第二临床医学院,甘肃兰州7300302.兰州大学第二医院神经外科,甘肃兰州7300303.兰州大学第二医院神经病学研究所,甘肃兰州730030摘要:胶质母细胞瘤是人类中枢神经系统肿瘤中恶性程度最高、预后最差的一类肿瘤,尽管目前对于胶质母细胞瘤可采取手术、辅助放射、化学药物等治疗方式,其预后仍然较差。新的起源学说认为胶质母细胞瘤中的胶质瘤干细胞可能起源于脑室下区,并且与该区的神经干细胞相关。而这种具有干细胞特性的肿瘤细胞与其他干细胞一样,拥有极强的DNA损伤修复能力,并且可以通过这种DNA损伤修复作用来增强肿瘤对于放射治疗的顽固抗性。该文探讨通过抑制DNA损伤修复的关键酶来拮抗胶质母细胞瘤的放疗抗性,提高患者预后的可能性。[国际神经病学神经外科学杂志,2023,50(1):64-68]关键词:胶质母细胞瘤;DNA依赖性蛋白激酶催化亚基抑制剂;胶质母细胞瘤干细胞;放疗抗性中图分类号:R739.41DOI:10.16636/j.cnki.jinn.1673-2642.2023.01.013RoleandprospectofDNA-PKcsinhibitorsintreatmentofglioblastomaFANGXiang1,TIANGuopeng1,BAIShengwei1,LUOYusong1,PANYawen1,2,31.TheSecondMedicalCollegeofLanzhouUniversity,Lanzhou,Gansu730030,China.2.DepartmentofNeurosurgery,LanzhouUniversitySecondHospital,Lanzhou,Gansu730030,China.3.InstituteofNeurology,LanzhouUniversitySecondHospital,Lanzhou,Gansu730030,China.Correspondingauthor:PANYawen,Email:panyawen666@sohu.comAbstract:Glioblastoma(GBM)isatypeofhumancentralnervoussystemtumorwiththehighestdegreeofmalignancyandtheworstprognosis.AlthoughGBMiscurrentlytreatedwithsurgicaltreatment,adjuvantradiotherapy,andchemothera-py,itstillhasapoorprognosis.Atpresent,thenewtheoryoforiginbelievesthatgliomastemcellsinGBMmayoriginatefromthesubventricularzoneandareassociatedwiththeneuralstemcellsinthiszone.Suchtumorcellswithstemness,likeotherstemcells,haveastrongabilityforDNAdamagerepairandcanthusenhancetheresistanceoftumortoradiotherapy.ThisarticledescribesthestrategiesforGBMaga...