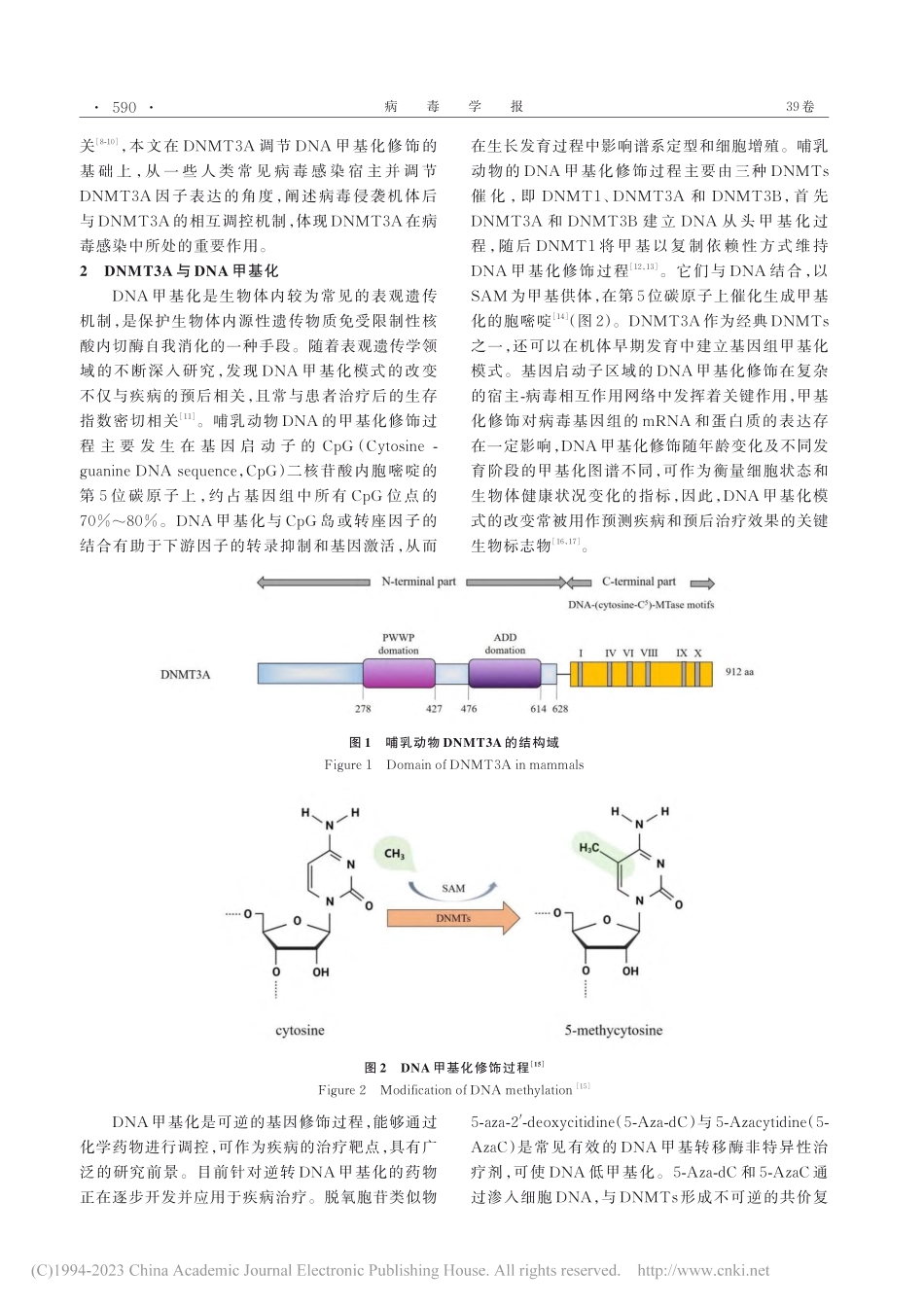
病毒学报CHINESEJOURNALOFVIROLOGYVol.39No.2March2023第39卷第2期2023年3月DNA甲基转移酶DNMT3A在人类常见病毒感染中的研究进展王绪萌1,于鑫1,翟爱霞2,王燕1*(1.哈尔滨医科大学基础医学院微生物学教研室,哈尔滨150081;2.中山大学附属第八医院,深圳518000)摘要:DNA甲基转移酶(DNAmethylationtransferases,DNMTs)是哺乳动物建立与维持基因甲基化的酶类家族,参与基因表达和调控等生物学过程。其中DNA甲基转移酶3A(DNAmethyltransferase3Alpha,DNMT3A)是机体重要DNMTs之一,DNMT3A突变或异常表达所诱导的基因甲基化引起机体相关因子活性失调进而诱发疾病发生,DNMT3A介导的基因甲基化与人类常见病毒感染所致疾病密切相关。本篇综述从人类常见病毒感染宿主的角度出发,对DNMT3A在促进病毒感染与诱发疾病中的作用进行阐述,为进一步探究以DNMT3A为病毒感染性疾病治疗靶点提供参考和思路。关键词:DNA甲基转移酶;DNAmethyltransferase3Alpha(DNMT3A);人类常见病毒中图分类号:R117R373.9文献标识码:A文章编号:1000‐8721(2023)02‐0589‐10DOI:10.13242/j.cnki.bingduxuebao.004296近年来,表观遗传学逐渐成为科学研究领域的热点,其中DNA甲基化作为一种经典的表观遗传学修饰过程,与机体自身生长发育及疾病的发生发展存在一定相关性。DNA甲基化修饰需要酶的作用,作为哺乳动物体内催化和维持DNA甲基化的一类酶即DNMTs。根据结合底物的差异性大体分为3种类型,即DNMT1、DNMT2和DNMT3。其中DNMT1结合底物为半甲基化DNA,具有维持DNA甲基化的功能[1];DNMT2的结合底物为tRNA,可以在转录水平对基因进行甲基化修饰;DNMT3包括4种酶,分别为DNMT3A、DNMT3B、DNMT3C和DNMT3L[2]。DNMT3A和DNMT3B可在细胞分裂初期结合未甲基化的核酸双链,催化链上新甲基化位点的出现和甲基修饰过程,行使从头甲基化功能;DNMT3C为新发现的一种甲基转移酶,参与雄性生殖细胞系启动子的甲基化过程[3];DNMT3L虽然不具有甲基转移酶的催化活性,但是可以调节其他甲基转移酶的活性。研究发现,DNMTs的异常表达,会造成甲基化状态紊乱,通常导致机体疾病发生,如DNMTs中的DNMT3A,在机体内发生突变或异常表达所诱导的基因甲基化与人类常见病毒感染所致疾病密切相关,因此DNMTs可以作为某些疾病潜在预测性诊断的生物标志和治疗靶点[4]。1DNMT3A的结构域现阶段,在学术领域对DNMT3A的研究日益增多,DNMT3A由912个氨基酸残基组成,为人类染色体上第23...