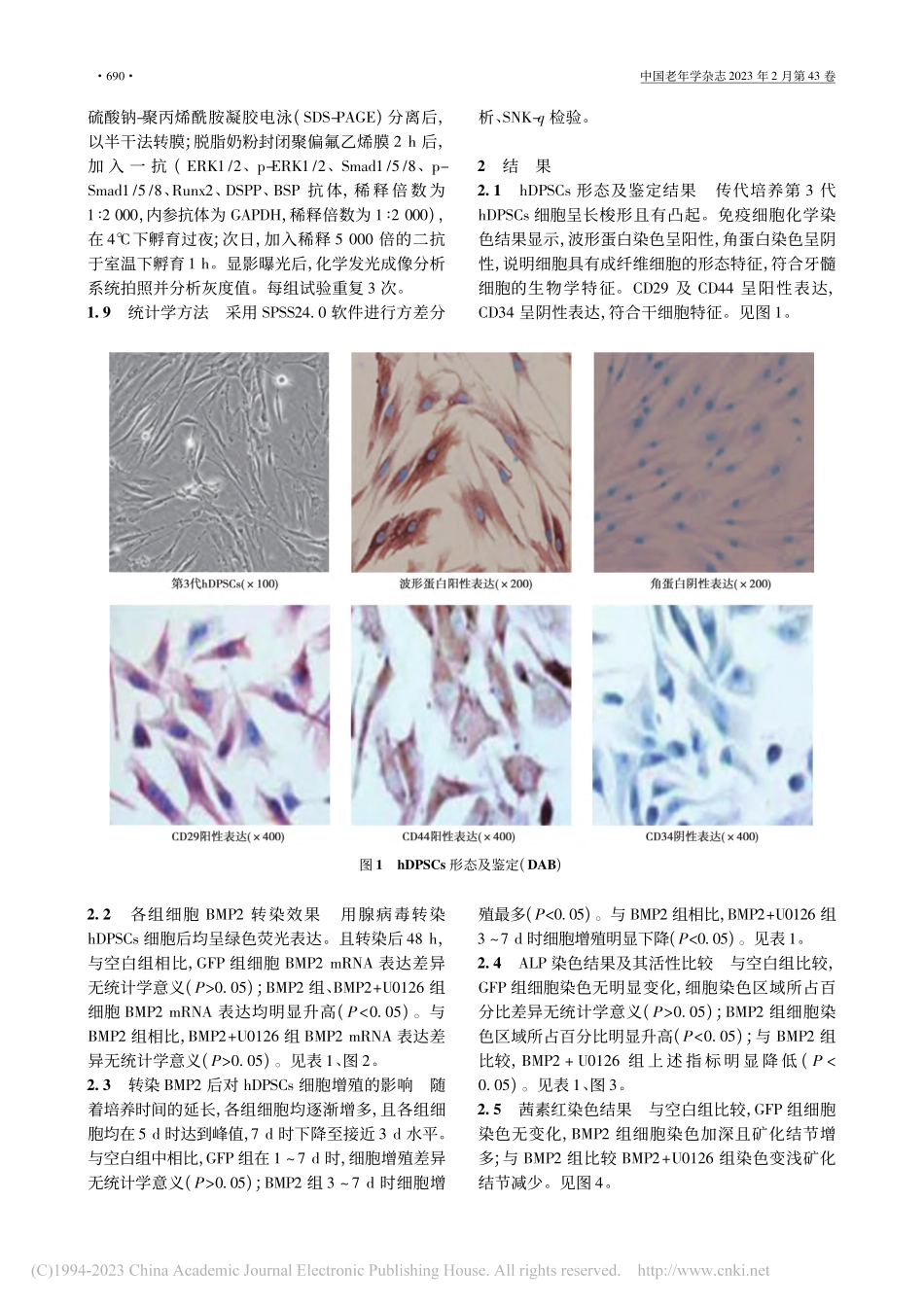
亡的分子机制〔J〕.中国老年学杂志,2019;39(15):3738-40.12MazumderS,PlescaD,AlmasanA.Caspase-3activationisacriticaldeterminantofgenotoxicstress-inducedapoptosis〔J〕.MethodMolBiol,2008;414:13-21.13朱宏亮,姜建伟,张建军.盐酸度洛西汀对大鼠应激性胃溃疡保护作用机制的初步探究〔J〕.中国新药杂志,2019;28(13):1612-8.14丁新,郑勇,李静等.长链非编码RNAXLOC009038促进食管鳞癌细胞增殖、迁移和侵袭〔J〕.实用医学杂志,2019;35(3):369-74.15张向颖,李红艳,任锋,等.清肠利肝方对急性肝衰竭小鼠肝细胞凋亡的影响〔J〕.中西医结合肝病杂志,2019;29(2):171-3.16MouratidisPX,ColstonkWA,DalgeishAG.Doxycyclineinducescaspase-dependentapoptosisinhumanpancreaticcancercells〔J〕.IntJCancer,2007;120(4):743-52.17李雨颖,邵喜英,金莉婷,等.川楝素通过Fas/FasL信号通路诱导人卵巢癌细胞凋亡〔J〕.中国中西医结合杂志,2019;39(9):1089-93.18ChenS,YangL,FengJ,etal.NitidinechlorideinhibitsproliferationandinducesapoptosisinovariancancercellsbyactivatingtheFassignallingpathway〔J〕.JPharmPharmacol,2018;70(6):778-86.〔2021-11-12修回〕(编辑杜娟)ERK/Smad通路在BMP2介导的牙髓干细胞增殖、分化中的作用沈玉芹1崔娟娟2鲁晓娟1(1皖西卫生职业学院附属医院口腔科,安徽六安237000;2安徽医科大学第一附属医院口腔科)〔摘要〕目的探讨细胞外调节蛋白激酶(ERK)/SMAD家族(Smad)通路在骨形态蛋白(BMP)-2诱导的人牙髓干细胞(hDPSCs)增殖、分化中的调节作用。方法将前磨牙hDPSCs分为空白组、荧光蛋白(GFP)组、BMP2组(80ng/ml)、BMP2+ERK通路抑制剂(U0126)组(80ng/ml+25μmol/L);空白组正常培养不做任何处理,GFP组转染重组腺病毒空载体溶液作为对照,BMP2组转染BMP2重组腺病毒溶液,BMP2+U0126组在BMP2组基础上加入U0126溶液进行干预培养。各组均培养7d后,用CCK-8检测hDPSCs细胞的增殖能力;用碱性磷酸酶(ALP)染色法及茜素红染色法检测其分化能力;用实时荧光定量聚合酶链反应(RT-qPCR)检测BMP2、Runt转录因子蛋白(Runx)2、牙本质涎磷蛋白(DSPP)和骨唾液蛋白(BSP)基因表达;用蛋白Western印迹法检测各组细胞中ERK1/2及其磷酸化(p)-ERK1/2、Smad1/5/8及其磷酸化蛋白(p-Smad1/5/8)、Runx2、DSPP、BSP蛋白表达水平。结果hDPSCs分离培养的第3代hDPSCs呈长梭形且阳性表达CD29、CD44及波形蛋白,阴性...