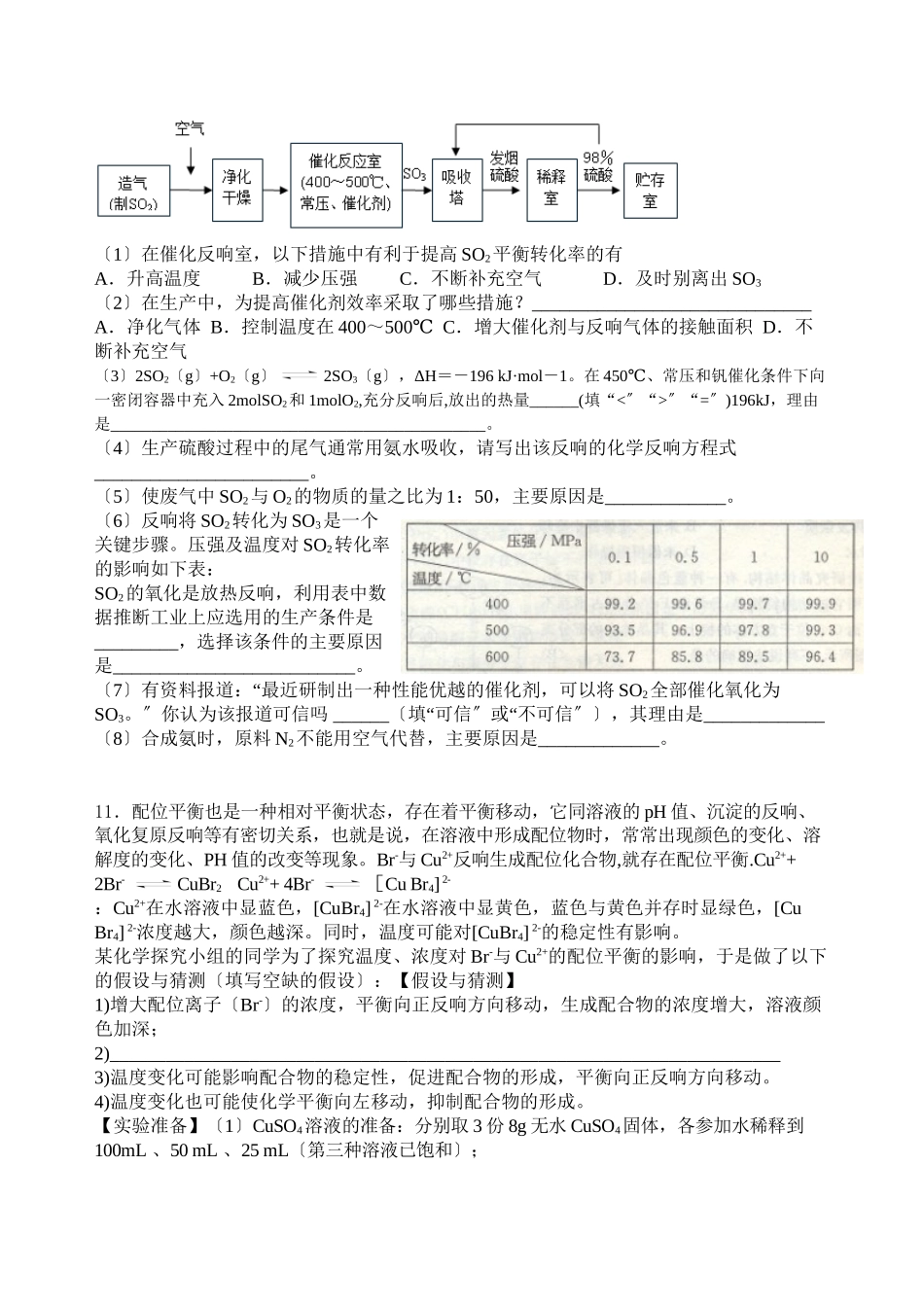
佛山实验中学专项练习----化学反响速率和化学平衡6.沉淀物并非绝对不溶,且在水及各种不同的溶液中溶解度有所不同,同离子效应、络合物的形成等都会使沉淀物的溶解度有所改变。AgCl+Cl-==[AgCl2]-,右图是某温度下AgCl在NaCl溶液中的溶解情况。由以上信息可知:〔1〕由图知该温度下AgCl的溶度积常数为_____________________。〔2〕AgCl在NaCl溶液中的溶解出现如以下图情况〔先变小后变大〕的原因是:__________________________________________。〔3〕设计实验证明S(AgCl)>S(AgI)>S(Ag2S),实验方案是_______________________________________________________。〔4〕假设在AgCl形成的浊液中滴加氨水有什么现象__________________________________________,发生反响的离子方程式为_______________________________________________________________。7.KI溶液在酸性条件下能被空气氧化。为了探究KI被氧化的速率,现有1mol/LKI溶液、0.1mol/LH2SO4溶液、淀粉溶液,实验记录如下:答复以下问题:〔1〕该实验的目的是________________,相应的离子方程式________________________________。〔2〕试剂参加的顺序为_____________。实验现象为________________。〔3〕由上述实验记录可得出反响速率受温度影响的经验规律是______。请用碰撞理论给予解释________________________________。〔4〕上述实验中必须保持不变的因素有_____________________。〔5〕假设要进行酸性对反响速率的影响的探究实验,那么必须改变______。A.KI溶液的浓度B.硫酸的浓度C.硫酸的体积D.淀粉溶液的体积〔6〕假设实验得知,反响速率v=k·c(H+)·c(I-),k为常数。请在以下坐标图中画出H2SO4的浓度分别为0.1mol/L和0.2mol/L时,显色时间与反响温度的变化曲线,并作出必要标示。8.氨是重要的化工原料,氨的合成和应用是当前的重要研究内容之一。传统哈伯法合成氨工艺中相关的反响式为:N2+3H22NH3。下表为研究合成氨平衡体系中NH3的物质的量分数与温度、压强的关系所得的数据,请答复以下问题:0.110203060100压强〔MPa〕氨平衡含量〔%〕温度〔℃〕实验编号①②③④⑤温度〔℃〕3040506070显色时间〔s〕1608040201020015.381.586.489.995.498.83002.252.064.271.084.292.64000.425.138.247.065.279.85000.110.619.126.442.257.56000.054.59.113.823.131.4⑴分析表中数据,____________________〔填温度和压强〕时转化率最高,实际工业生产不选该条件的主要原因是_______...