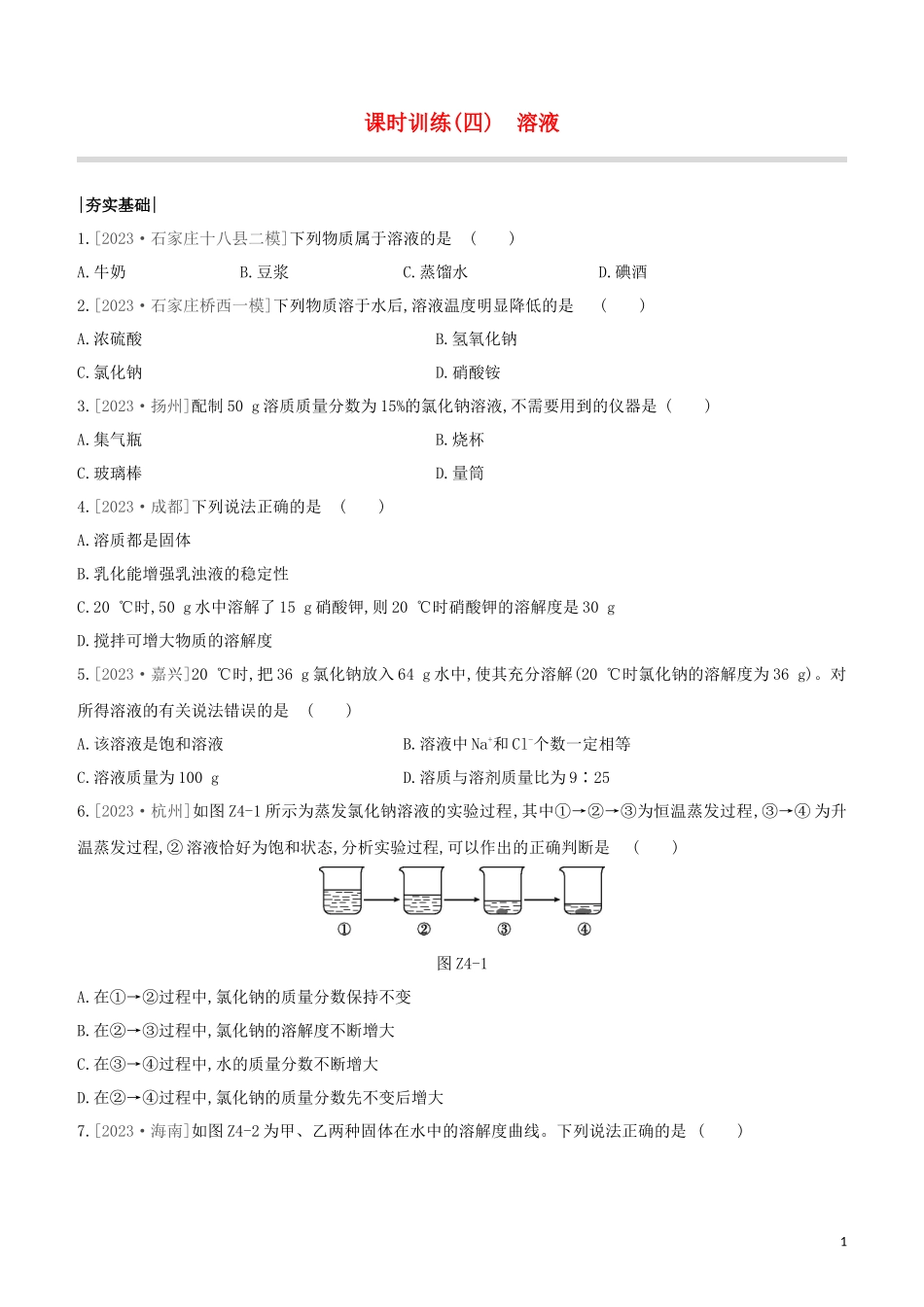
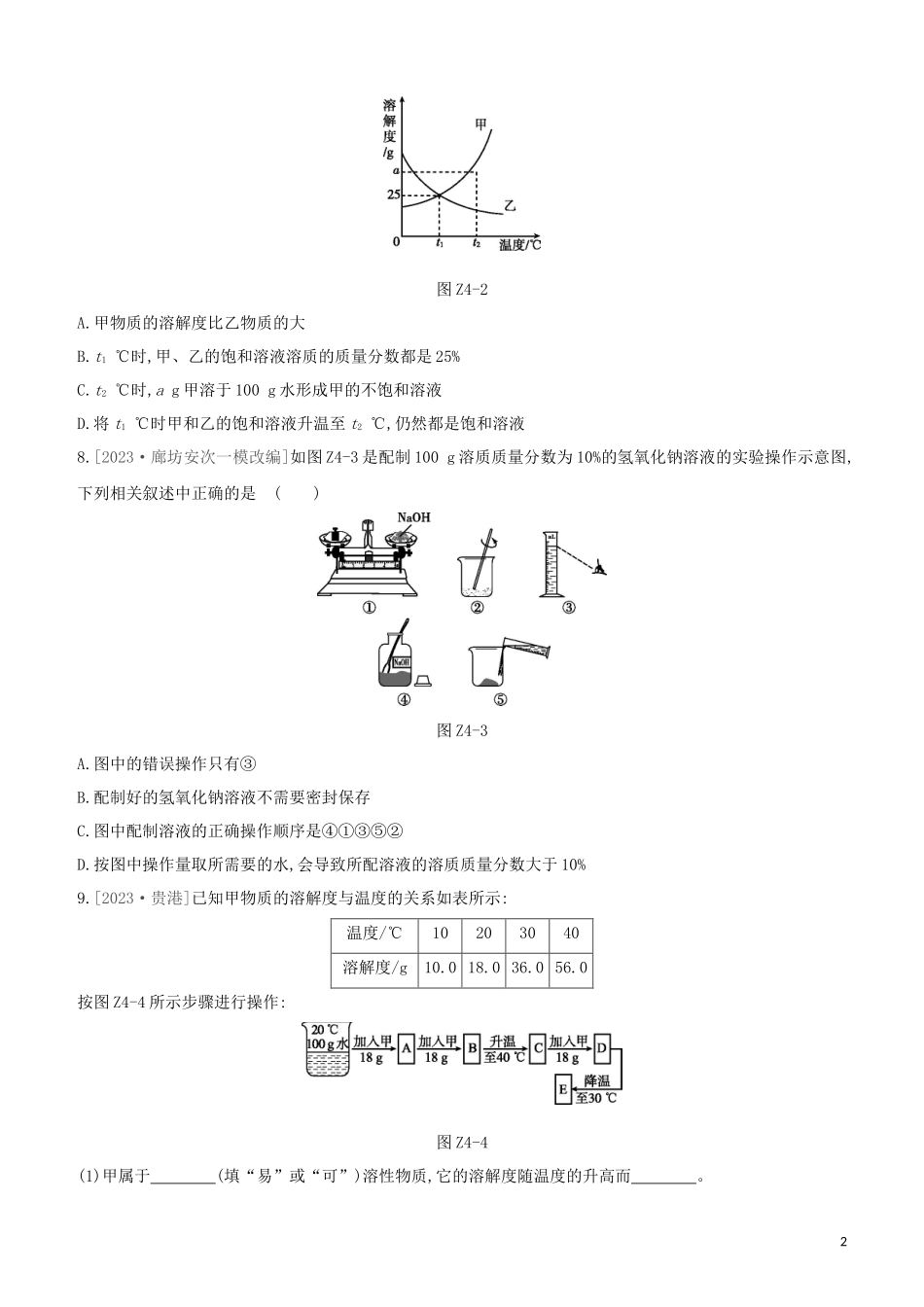
课时训练(四)溶液|夯实基础|1.[2023·石家庄十八县二模]下列物质属于溶液的是()A.牛奶B.豆浆C.蒸馏水D.碘酒2.[2023·石家庄桥西一模]下列物质溶于水后,溶液温度明显降低的是()A.浓硫酸B.氢氧化钠C.氯化钠D.硝酸铵3.[2023·扬州]配制50g溶质质量分数为15%的氯化钠溶液,不需要用到的仪器是()A.集气瓶B.烧杯C.玻璃棒D.量筒4.[2023·成都]下列说法正确的是()A.溶质都是固体B.乳化能增强乳浊液的稳定性C.20℃时,50g水中溶解了15g硝酸钾,则20℃时硝酸钾的溶解度是30gD.搅拌可增大物质的溶解度5.[2023·嘉兴]20℃时,把36g氯化钠放入64g水中,使其充分溶解(20℃时氯化钠的溶解度为36g)。对所得溶液的有关说法错误的是()A.该溶液是饱和溶液B.溶液中Na+和Cl-个数一定相等C.溶液质量为100gD.溶质与溶剂质量比为9∶256.[2023·...