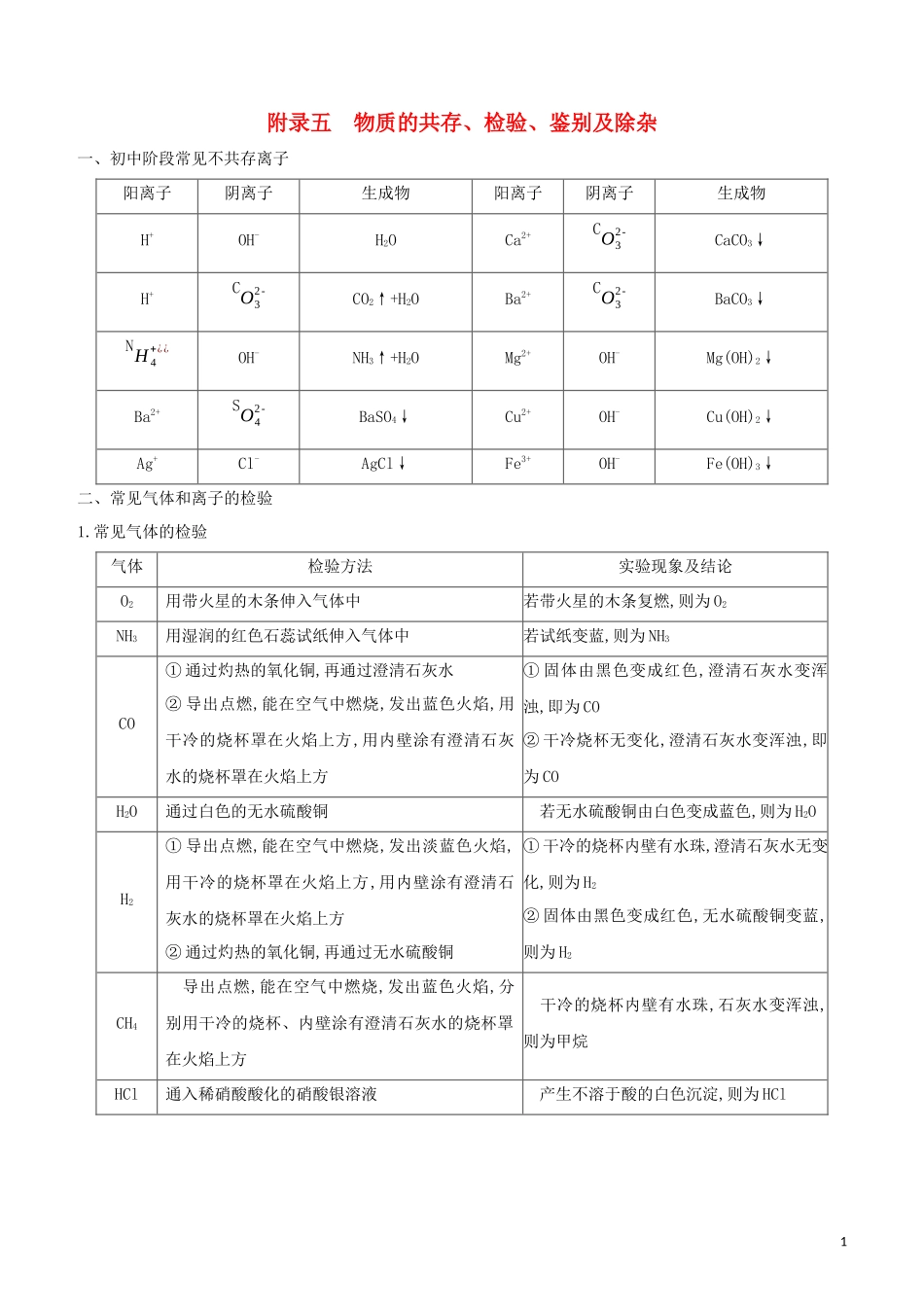
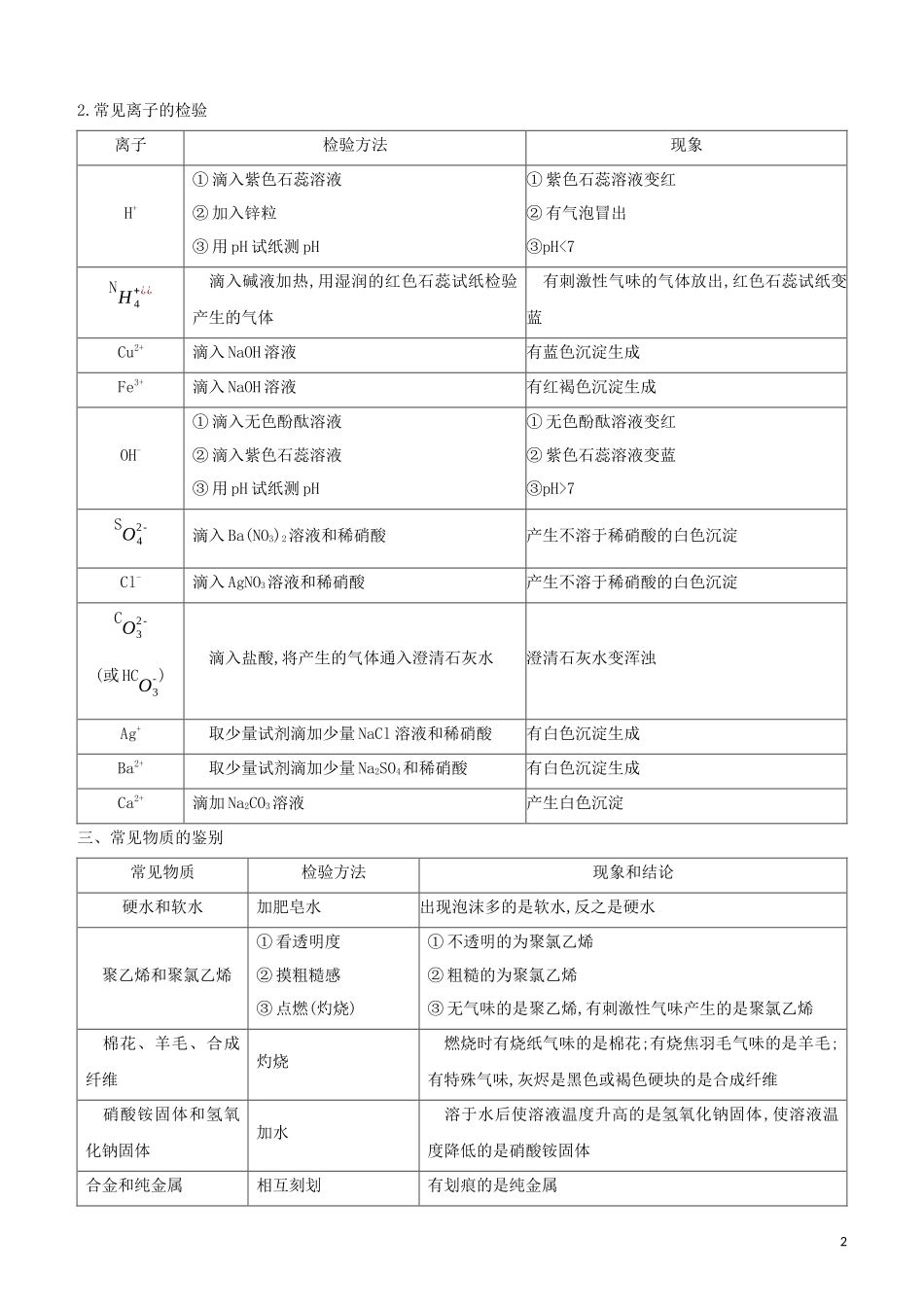
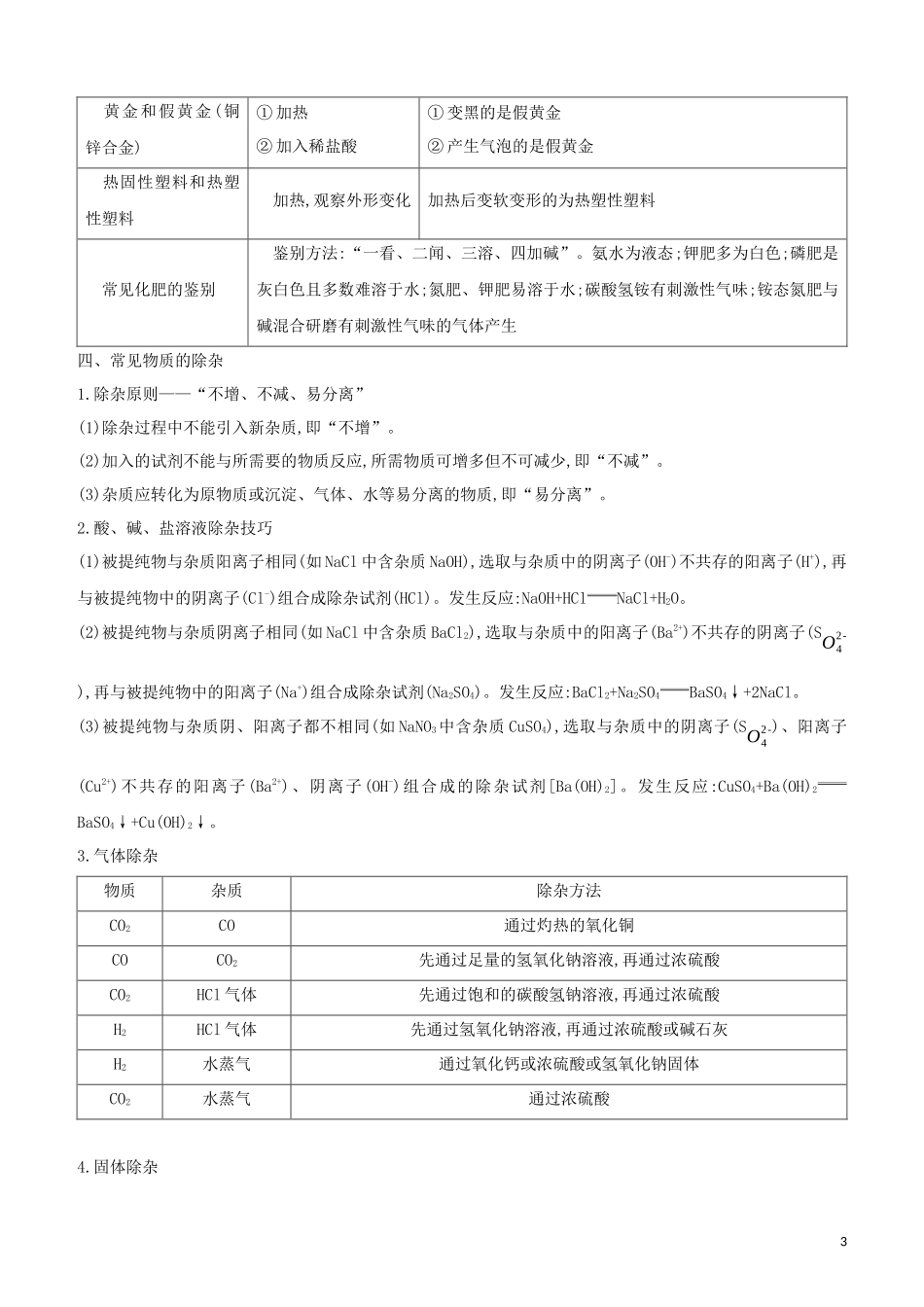
附录五物质的共存、检验、鉴别及除杂一、初中阶段常见不共存离子阳离子阴离子生成物阳离子阴离子生成物H+OH-H2OCa2+CO32-CaCO3↓H+CO32-CO2↑+H2OBa2+CO32-BaCO3↓NH4+¿¿OH-NH3↑+H2OMg2+OH-Mg(OH)2↓Ba2+SO42-BaSO4↓Cu2+OH-Cu(OH)2↓Ag+Cl-AgCl↓Fe3+OH-Fe(OH)3↓二、常见气体和离子的检验1.常见气体的检验气体检验方法实验现象及结论O2用带火星的木条伸入气体中若带火星的木条复燃,则为O2NH3用湿润的红色石蕊试纸伸入气体中若试纸变蓝,则为NH3CO①通过灼热的氧化铜,再通过澄清石灰水②导出点燃,能在空气中燃烧,发出蓝色火焰,用干冷的烧杯罩在火焰上方,用内壁涂有澄清石灰水的烧杯罩在火焰上方①固体由黑色变成红色,澄清石灰水变浑浊,即为CO②干冷烧杯无变化,澄清石灰水变浑浊,即为COH2O通过白色的无水硫酸铜...