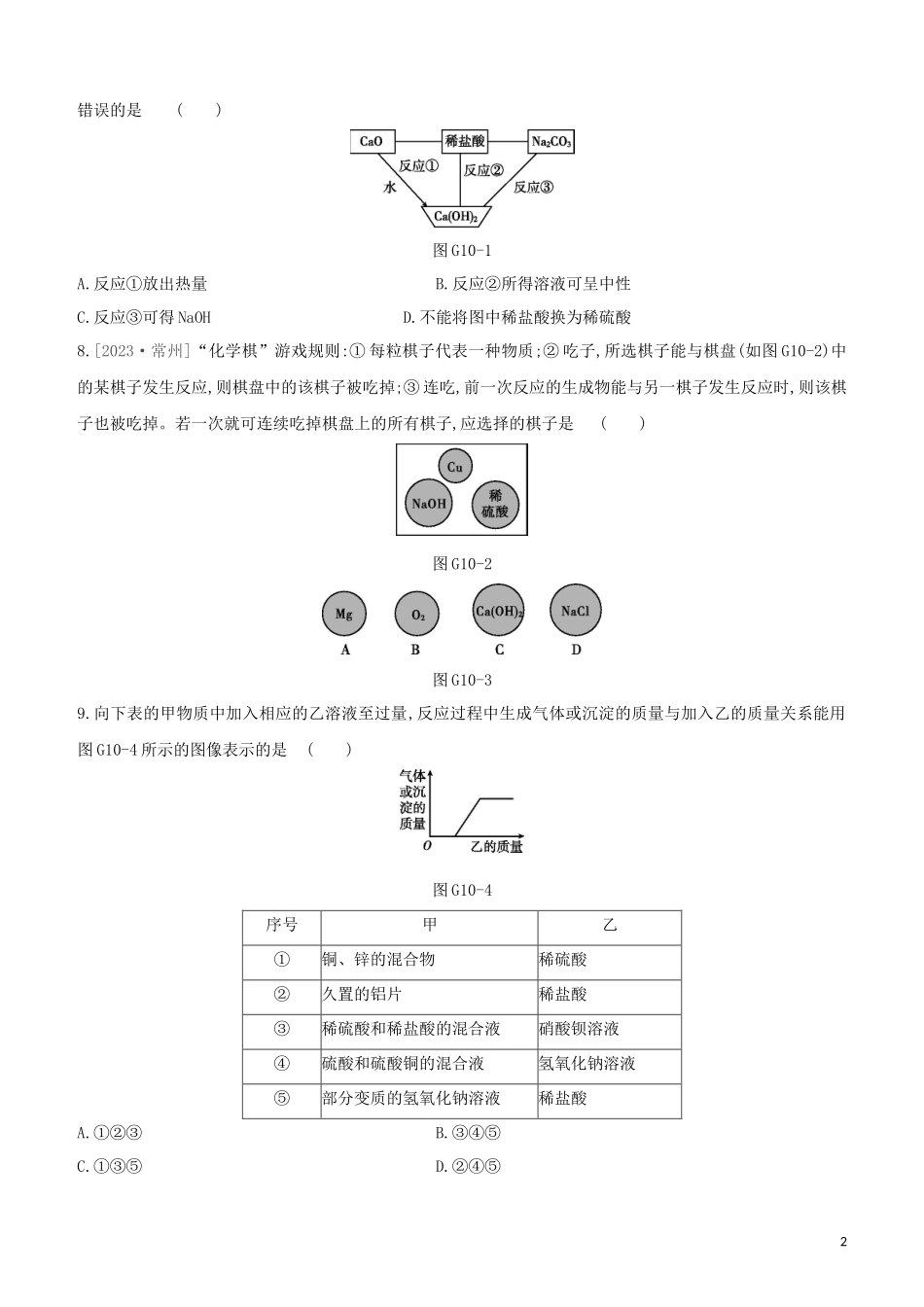
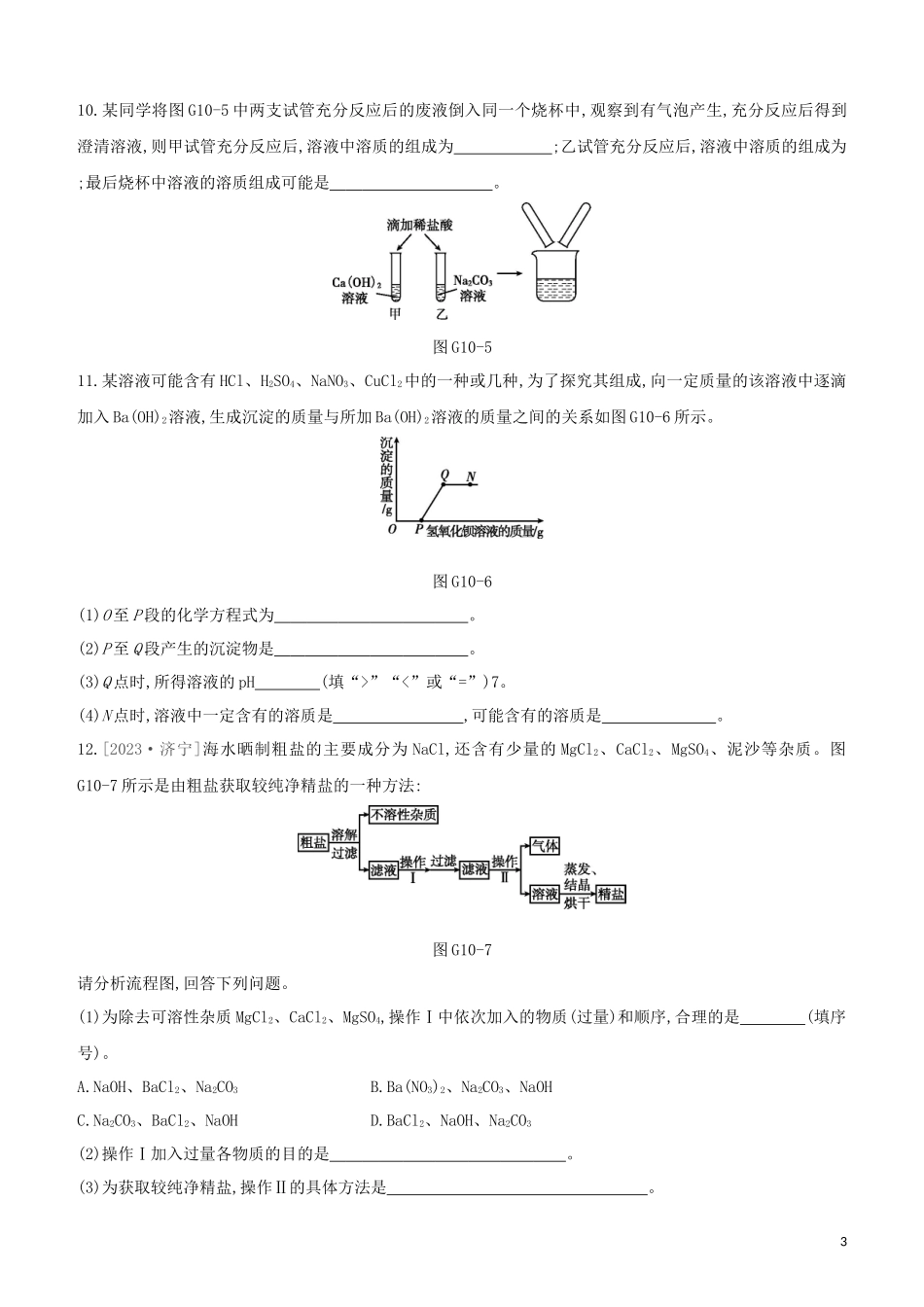
专项(十)酸碱盐之间的鉴别、共存及转化1.下列物质不能用于鉴别氢氧化钠溶液和稀盐酸的是()A.紫色石蕊溶液B.氯化钠溶液C.铁粉D.酚酞溶液2.[2023·乐山]下列物质之间的转化,只通过一步反应不能实现的是()A.Fe2O3→FeCl2B.KMnO4→MnO2C.CO2→COD.CuSO4→Cu(OH)23.[2023·遵义]下列各组离子能够在指定溶液中大量共存的一组是()A.在氯化钠溶液中:Zn2+、SO42-B.在稀盐酸中:Ag+、NO3-C.在硫酸钾溶液中:Ba2+、Cl-D.在硝酸铵溶液中:K+、OH-4.下列各组溶液,不外加试剂就不能鉴别出来的是()A.Na2CO3、Ca(OH)2、HClB.NaOH、FeCl3、HClC.Na2CO3、CuSO4、BaCl2D.NaOH、BaCl2、MgSO45.要将KCl、MgCl2和BaSO4的固体混合物逐一分离开来,加入的试剂及顺序正确的是()A.水、AgNO3溶液、稀硝酸B.水、NaOH溶液、稀盐酸C.水、KOH溶液、稀...