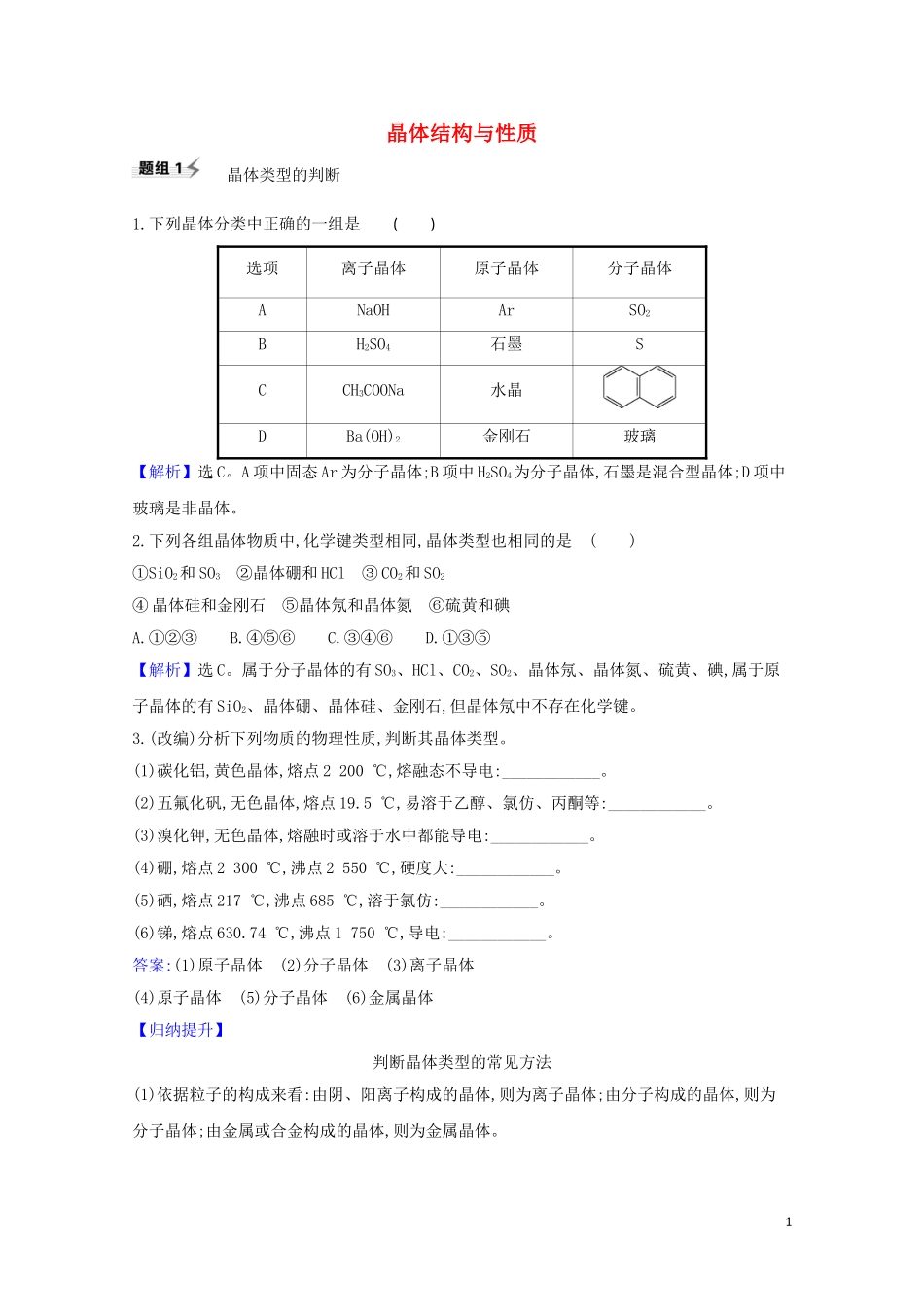
晶体结构与性质晶体类型的判断1.下列晶体分类中正确的一组是()选项离子晶体原子晶体分子晶体ANaOHArSO2BH2SO4石墨SCCH3COONa水晶DBa(OH)2金刚石玻璃【解析】选C。A项中固态Ar为分子晶体;B项中H2SO4为分子晶体,石墨是混合型晶体;D项中玻璃是非晶体。2.下列各组晶体物质中,化学键类型相同,晶体类型也相同的是()①SiO2和SO3②晶体硼和HCl③CO2和SO2④晶体硅和金刚石⑤晶体氖和晶体氮⑥硫黄和碘A.①②③B.④⑤⑥C.③④⑥D.①③⑤【解析】选C。属于分子晶体的有SO3、HCl、CO2、SO2、晶体氖、晶体氮、硫黄、碘,属于原子晶体的有SiO2、晶体硼、晶体硅、金刚石,但晶体氖中不存在化学键。3.(改编)分析下列物质的物理性质,判断其晶体类型。(1)碳化铝,黄色晶体,熔点2200℃,熔融态不导电:____________。(2)五氟化矾,无色晶体,...