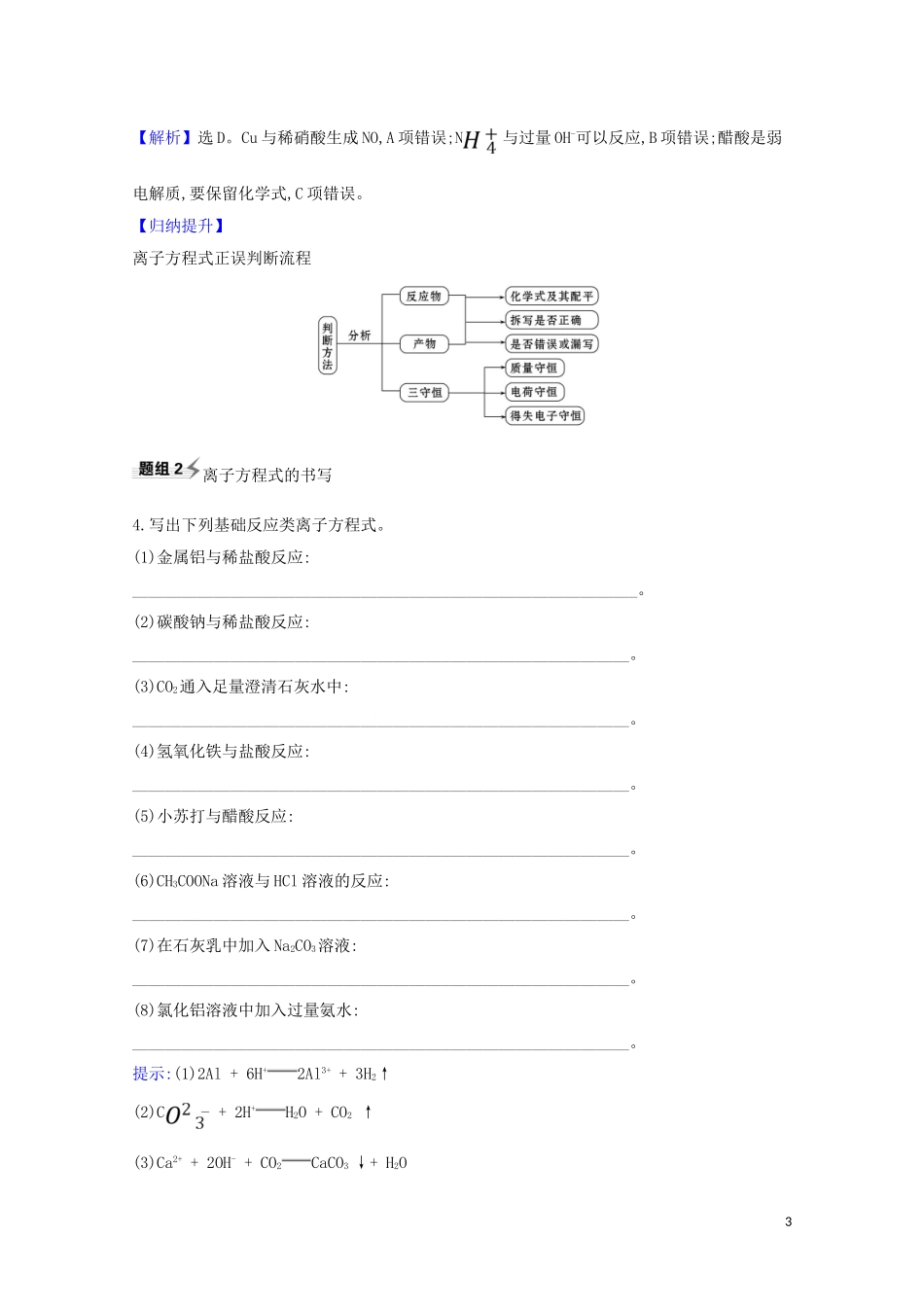
离子反应离子方程式正误判断1.(2023年·洛阳模拟)下列离子方程式正确的是()A.向FeO固体中加入少量稀硝酸:FeO+2H+Fe2++H2OB.向Na2S2O3溶液中加入过量稀硫酸:S2+2H+S↓+SO2↑+H2OC.向AlCl3溶液中加入过量氨水:Al3++4NH3·H2OAl+4N+2H2OD.向FeCl2溶液中加入氯水:Fe2++Cl2Fe3++2Cl-【解析】选B。FeO和稀硝酸发生氧化还原反应生成Fe(NO3)3、NO和H2O,A项错误;Na2S2O3与稀硫酸反应生成Na2SO4、S、SO2和H2O,B项正确;Al(OH)3不溶于NH3·H2O,C项错误;向FeCl2溶液中加入氯水的离子方程式为2Fe2++Cl22Fe3++2Cl-,D项错误。2.(2023年·延边模拟)下列离子方程式的书写及评价,均合理的是()选项离子方程式评价A将2molCl2通入含1molFeI2的溶液中:2Fe2++2I-+2Cl22Fe3++4Cl-+I2正确:Cl2过量,可将Fe2+、I-均氧化BBa(HCO3)2溶液与足量的N...