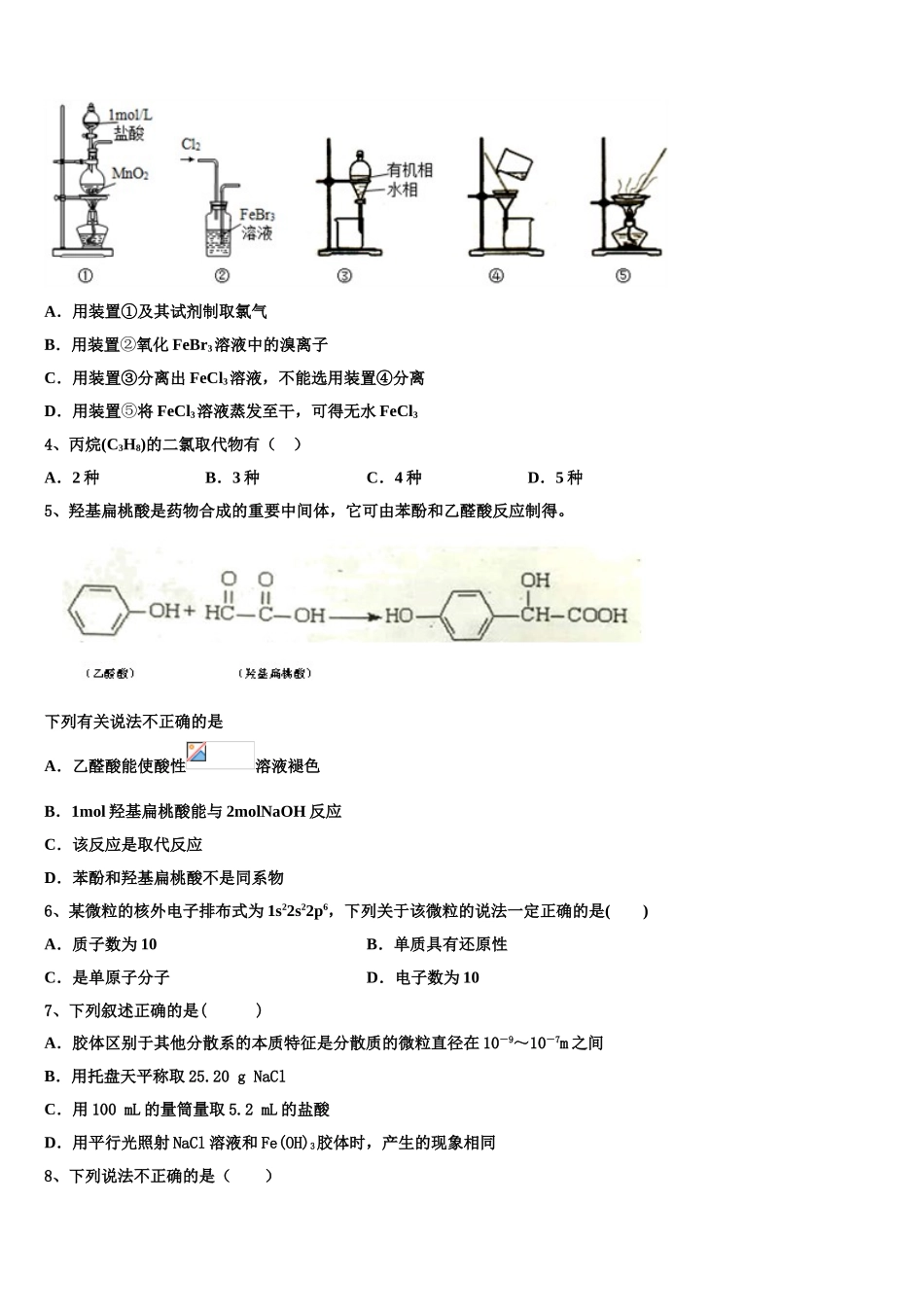
2023学年高二下学期化学期末模拟测试卷考生须知:1.全卷分选择题和非选择题两部分,全部在答题纸上作答。选择题必须用2B铅笔填涂;非选择题的答案必须用黑色字迹的钢笔或答字笔写在“答题纸”相应位置上。2.请用黑色字迹的钢笔或答字笔在“答题纸”上先填写姓名和准考证号。3.保持卡面清洁,不要折叠,不要弄破、弄皱,在草稿纸、试题卷上答题无效。一、选择题(每题只有一个选项符合题意)1、已知常温下,几种物质的电离平衡常数,下列反应的离子方程式正确的有几个弱酸HCOOHHCNH2CO3HClO苯酚K25℃K=1.77×10-4K=4.9×10-10K1=4.3×10-7K2=5.6×10-11K=2.98×10-8K=1.1×10-10①向苯酚钠溶液中通入少量的CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32-②次氯酸钙溶液中通入少量二氧化碳:Ca2++2ClO-+CO2+H2O=CaCO3↓+2HCl...