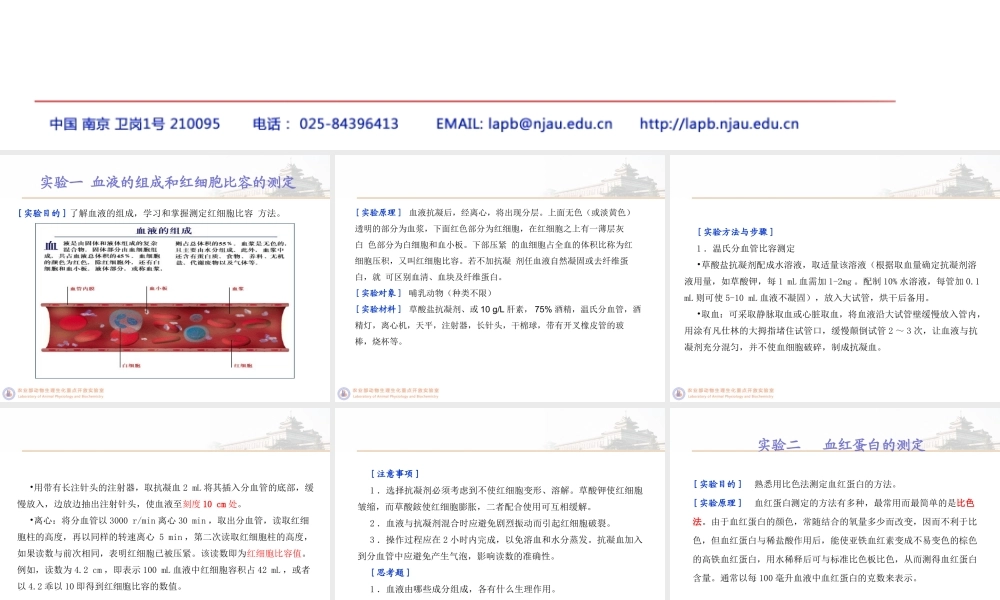
血液生理实验实验一血液的组成和红细胞比容的测定[实验目的]了解血液的组成,学习和掌握测定红细胞比容方法。[实验原理]血液抗凝后,经离心,将出现分层。上面无色(或淡黄色)透明的部分为血浆,下面红色部分为红细胞,在红细胞之上有一薄层灰白色部分为白细胞和血小板。下部压紧的血细胞占全血的体积比称为红细胞压积,又叫红细胞比容。若不加抗凝剂任血液自然凝固或去纤维蛋白,就可区别血清、血块及纤维蛋白。[实验对象]哺乳动物(种类不限)[实验材料]草酸盐抗凝剂、或10g/L肝素,75%酒精,温氏分血管,酒精灯,离心机,天平,注射器,长针头,干棉球,带有开叉橡皮管的玻棒,烧杯等。[实验方法与步骤]1.温氏分血管比容测定•草酸盐抗凝剂配成水溶液,取适量该溶液(根据取血量确定抗凝剂溶液用量,如草酸钾,每1mL血需加1-2mg。配制10%水溶液,每管加0.1mL则可使5-10mL血液不凝固),放入大试管,烘干后备用。•取血:可采取静脉取血或心脏取血,将血液沿大试管壁缓慢放入管内,用涂有凡仕林的大拇指堵住试管口,缓慢颠倒试管2~3次,让血液与抗凝剂充分混匀,并不使血细胞破碎,制成抗凝血。•用带有长注针头的注射器,取抗凝血2mL将其插入分血管的底部,缓慢放入,边放边抽出注射针头,使血液至刻度10cm处。•离心:将分血管以3000r/min离心30min,取出分血管,读取红细胞柱的高度,再以同样的转速离心5min,第二次读取红细胞柱的高度,如果读数与前次相同,表明红细胞已被压紧。该读数即为红细胞比容值。例如,读数为4.2cm,即表示100mL血液中红细胞容积占42mL,或者以4.2乖以10即得到红细胞比容的数值。[注意事项]1.选择抗凝剂必须考虑到不使红细胞变形、溶解。草酸钾使红细胞皱缩,而草酸銨使红细胞膨胀,二者配合使用可互相缓解。2.血液与抗凝剂混合时应避免剧烈振动而引起红细胞破裂。3.操作过程应在2小时内完成,以免溶血和水分蒸发。抗凝血加入到分血管中应避免产生气泡,影响读数的准确性。[思考题]1.血液由哪些成分组成,各有什么生理作用。2.血浆和血清有何区别,如何制备?3.测定红细胞比容的实际意义是什么?[实验目的]熟悉用比色法测定血红蛋白的方法。[实验原理]血红蛋白测定的方法有多种,最常用而最简单的是比色法。由于血红蛋白的颜色,常随结合的氧量多少而改变,因而不利于比色,但血红蛋白与稀盐酸作用后,能使亚铁血红素变成不易变色的棕色的高铁血红蛋白,用水稀释后可与标准比色板比色,从而测得血红蛋白含...