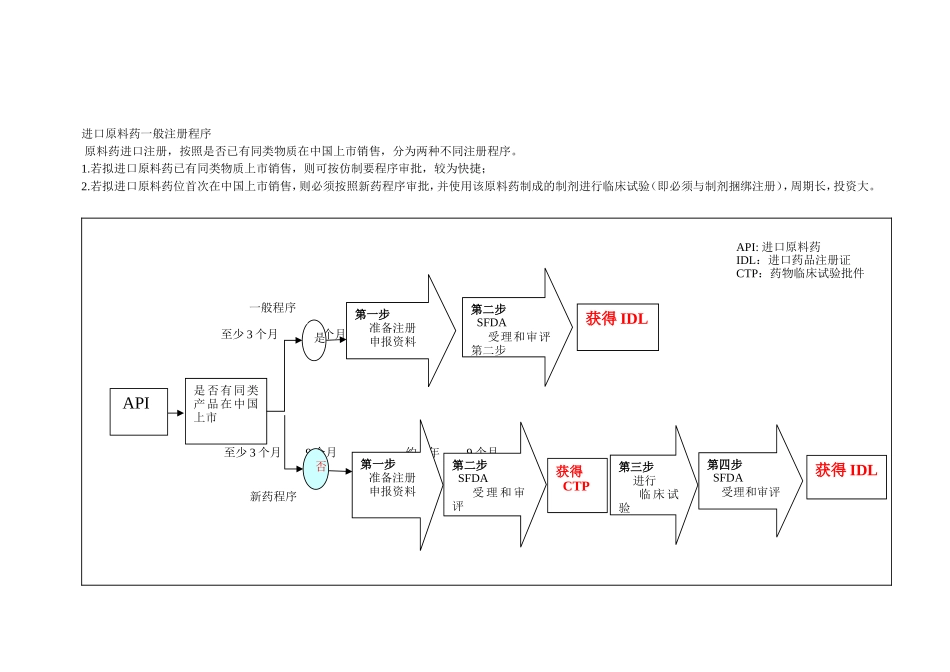
原料药进口注册流程进口化学药品注册证书核发,其分类按《药品注册管理办法》附件二注册分类,即:注册分类1、未在国内外上市销售的药品:注册分类3、已在国外上市销售但尚未在国内上市销售的药品:2进口原料药一般注册程序原料药进口注册,按照是否已有同类物质在中国上市销售,分为两种不同注册程序。1.若拟进口原料药已有同类物质上市销售,则可按仿制要程序审批,较为快捷;2.若拟进口原料药位首次在中国上市销售,则必须按照新药程序审批,并使用该原料药制成的制剂进行临床试验(即必须与制剂捆绑注册),周期长,投资大。至少3个月9个月至少3个月9个月约1年9个月API是否有同类产品在中国上市是否第一步准备注册申报资料第二步SFDA受理和审评第二步获得IDL第一步准备注册申报资料第二步SFDA受理和审评获得CTP第三步进行临床试验第四步SFDA受理和审评获得IDL一般程序新药程序API:进口原料药IDL:进口药品注册证CTP:药物临床试验批件原料药进口注册流程药品注册法(局令28号)http://www.sda.gov.cn/WS01/CL0053/24529.html申报制剂用的进口原料必须经过国家批准的一次性进口获得一次性进口批件,开展制剂研究(从所在省局开始,省局同意后,再拿着省局同意的证明去国家局申报一次性批件速度很快的,国家费用在2000)同时申报进口原料的IDL在获得临床批件或者生产批件前,取得进口原料的IDL生产临床用样品的进口原料.1.一次性进口原料药的程序及需准备哪些申报资料?有申报资料模板最好。答:到国家局网站上下载一个一次性原料药进口的申请;其具体程序如下:首先打一个报告给省局,说明要进口的原料药原因、数量等等(数量要有明细说明);报告后面附公司资质、拟进口原料药的相关资质。省局进行批复;省局批复后再报国家(连同省局批复和临时进口申请表),国家局审批后下发一次性进口药品注册批件,时间约2-3个月,审批费2000元。2、国内可以采用原料和制剂同时申报,进口原料是不是一定要拿到注册证后才能用于研究?答:进口原料药用于研究(比如小试、质量研究中的方法学等)无须获得进口药品注册证,仅有一次性进口药品批件即可。一次性进口”亦或“临时进口”1.许可条件:重大灾情、疫情所需药品,临床特需、急需药品,捐赠药品和研究用样品等,在尚未取得《进口药品注册证》的情况下,可经国家食品药品监督管理局特别批准进口。此类药品仅限在特定范围内用于特定目的。[1]2.申请材料[1]:1)书面申请报告;2)拟进口药品的相关材料,必...