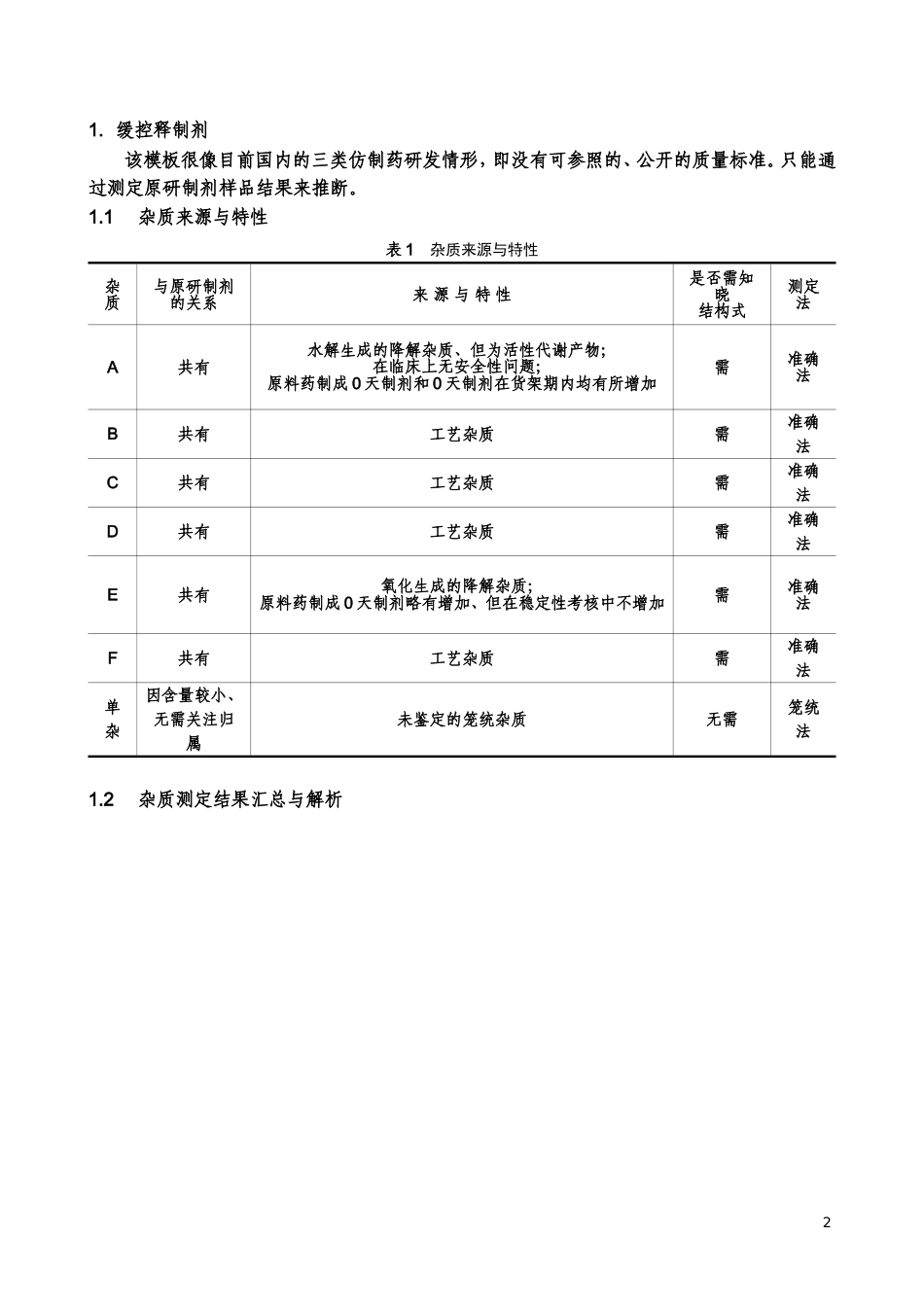
对美国FDA推荐的两个仿制药研发模板(原料药+制剂)解读与点评——暨如何科学客观、准确理性地制订杂质控制策略谢沐风(上海市食品药品检验所上海张衡路1500号201203)摘要:美国食品药品监督管理局属下的药品审评中心内的仿制药审评办公室于2006年推出了两个仿制药研发模板:原料药+速释口服固体制剂和原料药+缓控释口服固体制剂。作者通过解读和厘清其中的杂质控制策略,为我们提供了一条科学理性、准确客观的杂质研究思路。关键词:FDA仿制药研发模板杂质控制策略解读自2013年11月和2015年5月在《中国医药工业杂志》相继发表“仿制药研发中有关物质研究思路之我见[1]”和“再谈仿制药研发中杂质研究思路之我见[2]”文章后,收到大量同仁来电来函。在讨论交流“什么是客观科学的仿制药杂质研究思路”和“应如何正确理性地制订仿制药杂质控制策略”时,本人想到:美国食品药品监督管理局(FDA)属下的药品审评中心(CDER)内的仿制药审评办公室(OGD)于2006年推出的两个仿制药研发模板:原料药+速释口服固体制剂和原料药+缓控释口服固体制剂[3]。两模板十分经典、历经9年未有大的调整和更改。经过细致阅读和理解,此两模板中阐述的杂质研究与控制策略与本人文章中所述同出一辙、相辅相成。由此,想到撰写一篇读书心得,力争通过具体案例让众人能更精准地、更科学地认知与接受这些观点。11.缓控释制剂该模板很像目前国内的三类仿制药研发情形,即没有可参照的、公开的质量标准。只能通过测定原研制剂样品结果来推断。1.1杂质来源与特性表1杂质来源与特性杂质与原研制剂的关系来源与特性是否需知晓结构式测定法A共有水解生成的降解杂质、但为活性代谢产物;在临床上无安全性问题;原料药制成0天制剂和0天制剂在货架期内均有所增加需准确法B共有工艺杂质需准确法C共有工艺杂质需准确法D共有工艺杂质需准确法E共有氧化生成的降解杂质;原料药制成0天制剂略有增加、但在稳定性考核中不增加需准确法F共有工艺杂质需准确法单杂因含量较小、无需关注归属未鉴定的笼统杂质无需笼统法1.2杂质测定结果汇总与解析2表2杂质测定结果汇总与解析杂质原研制剂仿制原料药仿制制剂近效期样品测定结果测定结果【1】制订质量标准制订依据0天样品稳定性试验样品货架期样品测定结果放行标准加速试验12周长期试验12月质量标准制订依据A1.5%0.20%0.5%根据该杂质在制剂效期内增加量和制剂限度反推后酌情制订0.8%1.5%增加1.2%,所有样品测定结果≤2.0%增加0.5%,所有样品测定结果≤...