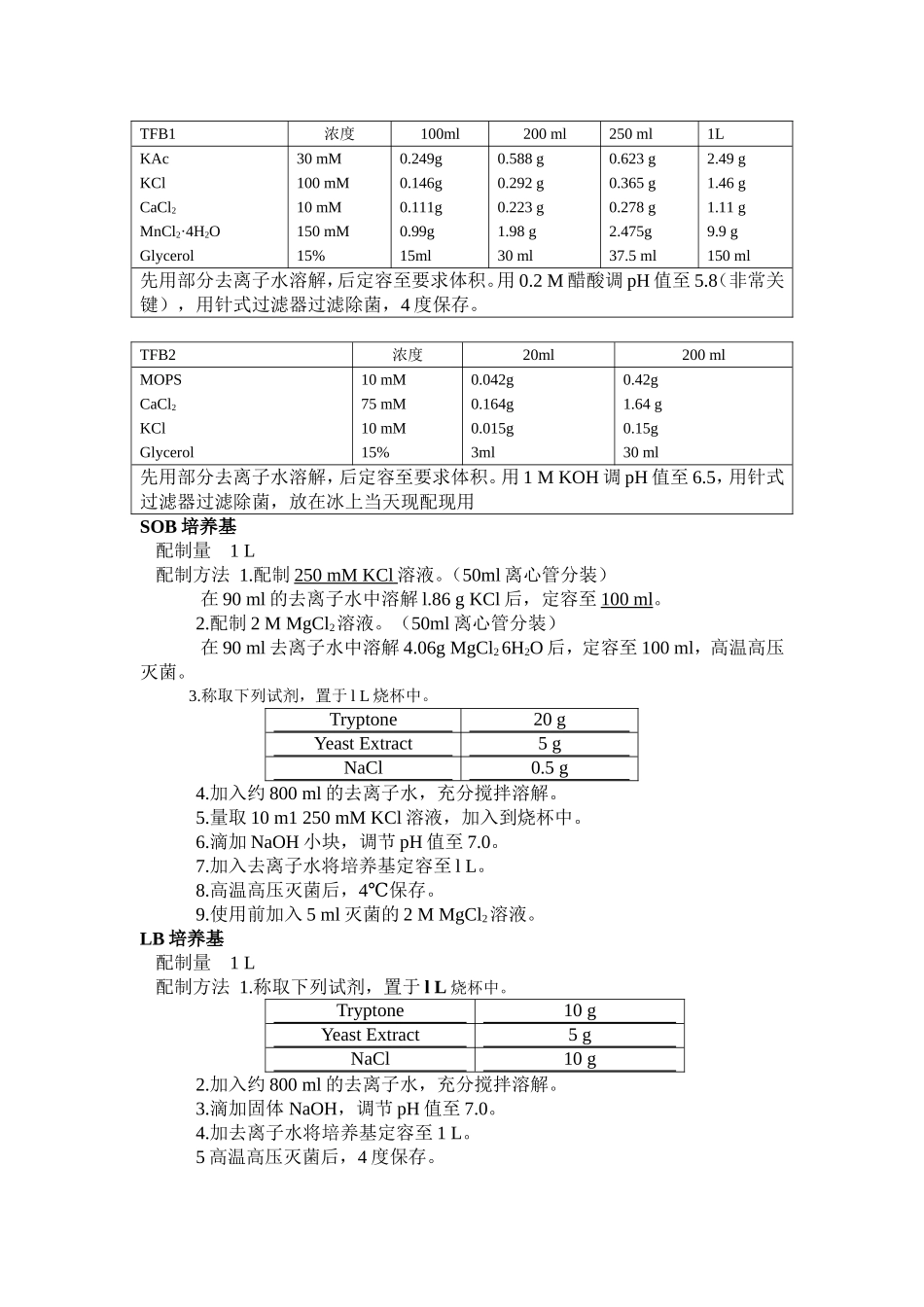
感受态细胞的制备(DH5α)一、准备工作所有试剂、容器均需提前预冷。1、实验器械4℃离心机(50ml离心管),37℃恒温箱,37℃摇床,超净台(使用前需要紫外消毒15min至少);0.22μm的滤器2个(过滤灭菌TfB2种溶液),10ml注射器2个;冰盒;高压灭菌的1.5mlEP管1盒,与离心机配套的50ml离心管6个(高压灭菌),高压灭菌的500ml锥形瓶2个,高压灭菌的100ml玻璃瓶2个,高压灭菌的1ml枪头和200μl枪头各一盒。2、试剂配制(甘油特别难吸,用蓝枪头慢慢吸吧)①LB平板:单纯LB平板,加有amp或有kana的(制板时需标注好类型,时间)。②SOB培养基(SuperOptimalBroth)③TfBⅠ:(100ml制备量)分别称取乙酸钾0.294g,MnCl20.99g,KCl0.146g,CaCl20.111g,置于200ml烧杯中,加入15ml甘油和85mlDDW,摇晃,使其全部溶解。然后在安全橱中用孔径为0.22μm的滤器过滤混合液,置于高压灭菌的100ml玻璃瓶中,4℃保存,使用前必须预冷。(装在50ml离心管,封口4度保存)④TfBⅡ(20ml制备量,每次现用现配,装在50ml离心管):分别称取MOPS0.046g,CaCl20.167g,KCl0.015g,置于50ml烧杯中,加入3ml甘油和17mlDDW,摇晃,使其全部溶解。然后在安全橱中用孔径为0.22μm的滤器过滤混合液,使用前必须预冷。终体积TFB1浓度100ml200ml250ml1LKAcKClCaCl2MnCl2·4H2OGlycerol30mM100mM10mM150mM15%0.249g0.146g0.111g0.99g15ml0.588g0.292g0.223g1.98g30ml0.623g0.365g0.278g2.475g37.5ml2.49g1.46g1.11g9.9g150ml先用部分去离子水溶解,后定容至要求体积。用0.2M醋酸调pH值至5.8(非常关键),用针式过滤器过滤除菌,4度保存。TFB2浓度20ml200mlMOPSCaCl2KClGlycerol10mM75mM10mM15%0.042g0.164g0.015g3ml0.42g1.64g0.15g30ml先用部分去离子水溶解,后定容至要求体积。用1MKOH调pH值至6.5,用针式过滤器过滤除菌,放在冰上当天现配现用SOB培养基配制量1L配制方法1.配制250mMKCl溶液。(50ml离心管分装)在90ml的去离子水中溶解l.86gKCl后,定容至100ml。2.配制2MMgCl2溶液。(50ml离心管分装)在90ml去离子水中溶解4.06gMgCl26H2O后,定容至100ml,高温高压灭菌。3.称取下列试剂,置于lL烧杯中。Tryptone20gYeastExtract5gNaCl0.5g4.加入约800ml的去离子水,充分搅拌溶解。5.量取10m1250mMKCl溶液,加入到烧杯中。6.滴加NaOH小块,调节pH值至7.0。7.加入去离子水将培养基定容至lL。8.高温高压灭菌后,4℃保存。9.使用前加入5ml灭菌的2MMgCl2溶液。LB培养基配制量1L...